Hvad er fakta om PH?
fakta om pH:
1. Definition: PH står for "potentiale for brint", som er et mål for surhedsgraden eller alkaliniteten af en opløsning.
2. Skala: PH -skalaen varierer fra 0 til 14 med:
* 0 til 6,9: Sur
* 7: Neutral
* 7,1 til 14: Alkalisk (eller grundlæggende)
3. Logaritmisk skala: PH -skalaen er logaritmisk, hvilket betyder, at hvert hele antal ændringer i pH repræsenterer en ti gange ændring i hydrogenionkoncentration.
4. Hydrogenioner: PH måler koncentrationen af hydrogenioner (H+) i en opløsning. Jo højere koncentration af H+, jo mere sur er opløsningen.
5. Hydroxidioner: Koncentrationen af hydroxidioner (OH-) er omvendt proportional med koncentrationen af hydrogenioner. Dette betyder en højere koncentration af H+ betyder en lavere koncentration af OH- og vice versa.
6. Betydning: PH er afgørende i mange biologiske, kemiske og industrielle processer. For eksempel:
* menneskelig krop: Blod pH er tæt reguleret inden for et smalt interval (7,35-7,45) for korrekt kropslig funktion.
* Landbrug: Jord PH påvirker plantevækst og næringsstoftilgængelighed.
* Industri: PH er vigtig i kemiske reaktioner, fødevareforarbejdning og spildevandsbehandling.
7. Måling af pH: pH kan måles ved hjælp af:
* pH -meter: En elektronisk enhed, der måler den elektriske potentialeforskel mellem en referenceelektrode og en pH-følsom elektrode.
* lakmuspapir: Papir behandlet med et farvestof, der ændrer farve afhængigt af pH i opløsningen.
8. Universal indikator: En blanding af flere farvestoffer, der ændrer farve gennem en lang række pH -værdier.
9. Neutral pH: Rent vand har en pH på 7 ved 25 ° C.
10. PH kan ændre sig: Faktorer såsom temperatur, tilstedeværelse af opløste stoffer og kemiske reaktioner kan ændre pH i en opløsning.
Dette er bare nogle grundlæggende kendsgerninger om PH. Begrebet pH er komplekst og har mange vigtige anvendelser inden for forskellige felter.
Sidste artikelHvad indikerer underskrifter i en kemisk formel?
Næste artikelForskel mellem fysisk forandring og kemisk forandring?
 Varme artikler
Varme artikler
-
 Et bannerår for pharmaKredit:CC0 Public Domain Da 2018 lakker mod enden, medicinalindustrien fejrer et fremgangsår med nye investeringer og terapeutiske gennembrud. Disse succeser var drevet af banebrydende videnskab o
Et bannerår for pharmaKredit:CC0 Public Domain Da 2018 lakker mod enden, medicinalindustrien fejrer et fremgangsår med nye investeringer og terapeutiske gennembrud. Disse succeser var drevet af banebrydende videnskab o -
 Vigtige trin til transformation af giftige molekyler i luft ved lave temperaturerBiludstødningsluftforurening i byer. Novosibirsk, vinter 2021. Kredit:S. Dukhovnikov Luftforurening fra brændstofforbrænding er et af de største miljøproblemer, især i bymiljøer. I tæt befolkede b
Vigtige trin til transformation af giftige molekyler i luft ved lave temperaturerBiludstødningsluftforurening i byer. Novosibirsk, vinter 2021. Kredit:S. Dukhovnikov Luftforurening fra brændstofforbrænding er et af de største miljøproblemer, især i bymiljøer. I tæt befolkede b -
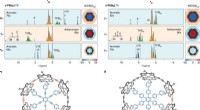 Største rekord for aromatisk ringstørrelse brudt med 162 π elektronerH NMR-spektre af de aromatiske og antiaromatiske seks-porphyrin nanoreringsskabelonkomplekser i oxidationstilstande 2+, 4+ og 6+. Kredit: Naturkemi (2020). DOI:10.1038/s41557-019-0398-3 Et team
Største rekord for aromatisk ringstørrelse brudt med 162 π elektronerH NMR-spektre af de aromatiske og antiaromatiske seks-porphyrin nanoreringsskabelonkomplekser i oxidationstilstande 2+, 4+ og 6+. Kredit: Naturkemi (2020). DOI:10.1038/s41557-019-0398-3 Et team -
 En ny metode til at udskrive spejle af variabel størrelse med en reflektionsevne på mere end 99 %Farvet spejllag printet på en folie. Inkjet-udskrivning giver mulighed for strukturering, således at store logoer også kan udskrives. Kredit:Qihao Jin, KIT Dielektriske spejle, også kaldet Bragg-sp
En ny metode til at udskrive spejle af variabel størrelse med en reflektionsevne på mere end 99 %Farvet spejllag printet på en folie. Inkjet-udskrivning giver mulighed for strukturering, således at store logoer også kan udskrives. Kredit:Qihao Jin, KIT Dielektriske spejle, også kaldet Bragg-sp
- Hvilken forbindelse er mere polær og opløselig i vandmetan eller methanol Hvorfor?
- Sygdomstrussel kan ændre, hvordan frøer parrer sig
- Sådan fungerer Grow Houses
- Hvilken stjerne ser ikke ud til at bevæge sig, og hvorfor?
- Beijing forlader listen over 200 mest forurenede byer
- Hvad hedder ringer omkring solen?


