Hvad reduceres, og hvad oxiderede i Cl2 plus 2nabr - 2BR 2NACl?
Forståelse af oxidation og reduktion
* Oxidation: Tab af elektroner. Oxidationsnummeret for et element øges.
* reduktion: Gevinst af elektroner. Oxidationsnummeret for et element falder.
Anvendelse af koncepterne
1. Tildel oxidationsnumre:
* cl₂: Hvert kloratom har et oxidationsnummer på 0 (elementær tilstand).
* NABR: Natrium (NA) er +1, og brom (BR) er -1.
* br₂: Hvert bromatom har et oxidationsnummer på 0 (elementær tilstand).
* NaCl: Natrium (NA) er +1, og chlor (CL) er -1.
2. Identificer ændringer:
* brom (Br): Oxidationsantallet af brom går fra -1 i NABR til 0 i br₂. Dette er et * tab * af elektroner, så brom er oxideret .
* klor (Cl): Oxidationsantallet af klor går fra 0 i Cl₂ til -1 i NaCl. Dette er en * gevinst * af elektroner, så klor er reduceret .
resume
* Oxidation: Br⁻ → Br₂ (brom oxideres)
* reduktion: Cl₂ → 2Cl⁻ (klor reduceres)
reaktionen
Reaktionen er et klassisk eksempel på en enkelt forskydningsreaktion . Den mere reaktive klor fortrænger brom fra natriumbromid.
Sidste artikelOpløseligheden af en gas i væske er hvad?
Næste artikelHvad er gasens evne til at spredes helt ud og blande med andet stof?
 Varme artikler
Varme artikler
-
 Polymerer går sammen om at levereEt TEM-billede af de opnåede nanokapsler. Kredit:The Royal Society of Chemistry En overkommelig, tungmetal- og lugtfri metode til fremstilling af hule polymer nanostrukturer er designet af A*STAR
Polymerer går sammen om at levereEt TEM-billede af de opnåede nanokapsler. Kredit:The Royal Society of Chemistry En overkommelig, tungmetal- og lugtfri metode til fremstilling af hule polymer nanostrukturer er designet af A*STAR -
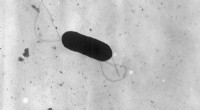 Stop listeria reproduktion i sine sporElektronmikrograf af en flagelleret Listeria monocytogenes -bakterie, Forstørret 41, 250X. Kredit:CDC/public domain Listeria -forureninger kan sende fødevareforarbejdningsfaciliteter i fuld krise
Stop listeria reproduktion i sine sporElektronmikrograf af en flagelleret Listeria monocytogenes -bakterie, Forstørret 41, 250X. Kredit:CDC/public domain Listeria -forureninger kan sende fødevareforarbejdningsfaciliteter i fuld krise -
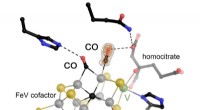 Vanadiumafhængig nitrogenase kan binde to CO-molekyler samtidigtJern-vanadium (FeV) cofaktoren i vanadiumafhængig nitrogenase blev lavet til at reagere med carbonmonoxid (CO) og derefter gasset under tryk, tillader to molekyler af substratet at blive visualiseret
Vanadiumafhængig nitrogenase kan binde to CO-molekyler samtidigtJern-vanadium (FeV) cofaktoren i vanadiumafhængig nitrogenase blev lavet til at reagere med carbonmonoxid (CO) og derefter gasset under tryk, tillader to molekyler af substratet at blive visualiseret -
 Farvede broderitråde efter behov sparer tid, penge og miljøKredit:Coloreel Det svenske firma Coloreel annoncerer partnerskab med Ricoh, den japanske teknologigigant, at revolutionere tekstilindustrien. Partnerskabet vil lancere en EU-støttet innovation, s
Farvede broderitråde efter behov sparer tid, penge og miljøKredit:Coloreel Det svenske firma Coloreel annoncerer partnerskab med Ricoh, den japanske teknologigigant, at revolutionere tekstilindustrien. Partnerskabet vil lancere en EU-støttet innovation, s
- Hvad er de forskellige eksempler på bioinvasion?
- Verdens hurtigste Bose-Einstein kondensat skabt
- Hvilke tre kriterier ledte Thomas Hunt Morgan efter i genetiske undersøgelser af en modelorganisme?…
- Soliton-molekyler fik til at vibrere som rigtige molekyler
- Talen om 'kristen nationalisme' bliver meget højere. Men hvad betyder udtrykket egentlig?
- Fremtrædende akademikere efterlyser mere videnskab inden for retsmedicin


