Hvordan finder du det teoretiske kogepunkt for en løsning?
1. Forstå begrebet kogepunkthøjde:
* rent opløsningsmiddel: Et rent opløsningsmiddel har et specifikt kogepunkt.
* Løsning: Når et opløst stof (som salt) opløses i et opløsningsmiddel (som vand), øges kogepunktet for opløsningen. Dette fænomen kaldes kogepunkthøjde.
2. Brug formlen:
Formlen til beregning af kogepunkthøjde er:
ΔTb =kb * m
Hvor:
* ΔTB: Ændringen i kogepunkt (i ° C eller ° F)
* kb: Molal kogepunktforhøjningskonstant (en egenskab ved opløsningsmidlet i ° C/molal eller ° F/molal)
* m: Molaliteten af opløsningen (mol opløst stof pr. Kg opløsningsmiddel)
3. Beregn molaliteten (m):
* molalitet: Molalitet (M) er antallet af mol opløst stof opløst i 1 kg opløsningsmiddel.
* for at finde m:
* Bestem molen af opløst stof.
* Bestem massen af opløsningsmidlet i kg.
* Opdel molen af opløst stof med massen af opløsningsmidlet i kg.
4. Slå op i molal kogepunkthøjde konstant (KB):
* KB er en specifik egenskab ved opløsningsmidlet. Du kan finde det i tabeller eller referencemateriale.
* for eksempel:
* KB for vand er 0,512 ° C/molal.
* KB for benzen er 2,53 ° C/molal.
5. Beregn ændringen i kogepunkt (ΔTB):
* Sæt værdierne for KB og M i formlen.
* Beregn Δtb.
6. Bestem det teoretiske kogepunkt:
* Tilføj ændringen i kogepunkt (ΔTB) til det normale kogepunkt for det rene opløsningsmiddel.
Eksempel:
Hvad er det teoretiske kogepunkt for en opløsning, der indeholder 0,5 mol NaCl opløst i 1 kg vand?
* KB for vand =0,512 ° C/molal
* m =0,5 mol / 1 kg =0,5 molal
* ΔTb =kb * m =0,512 ° C/molal * 0,5 molal =0,256 ° C
* Normalt kogepunkt af vand =100 ° C
* Teoretisk kogepunkt af opløsningen =100 ° C + 0,256 ° C =100,256 ° C
Vigtige noter:
* Formlen antager ideelle løsninger, hvor interaktionerne mellem opløst stof og opløsningsmiddel er minimale.
* Formlen er til ikke-flygtige opløste stoffer. For flygtige opløste stoffer skal du overveje damptrykket af opløstelsen.
* Kogepunkthøjden er en kolligativ egenskab, hvilket betyder, at det afhænger af koncentrationen af opløste partikler, ikke deres identitet.
 Varme artikler
Varme artikler
-
 Ny stofbelægning kunne forhindre kemiske våben, redde livEn ny stofbelægning kunne neutralisere kemiske våben og hjælpe med at redde utallige liv. Kredit:American Chemical Society Kemiske våben er mareridtsagtige. På et millisekund, de kan dræbe hundred
Ny stofbelægning kunne forhindre kemiske våben, redde livEn ny stofbelægning kunne neutralisere kemiske våben og hjælpe med at redde utallige liv. Kredit:American Chemical Society Kemiske våben er mareridtsagtige. På et millisekund, de kan dræbe hundred -
 Kemisk proces nedbryder lignin og gør birketræ til brugbare kemiske produkterDette billede viser den kemiske reaktor, der blev brugt i undersøgelsen til at spalte træ til træmasse og ligninolie. Kredit:KU Leuven Et team af forskere tilknyttet flere institutioner i Belgien
Kemisk proces nedbryder lignin og gør birketræ til brugbare kemiske produkterDette billede viser den kemiske reaktor, der blev brugt i undersøgelsen til at spalte træ til træmasse og ligninolie. Kredit:KU Leuven Et team af forskere tilknyttet flere institutioner i Belgien -
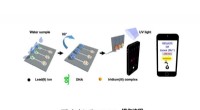 Ny enhed til hurtig og præcis detektering af blyDiagrammet viser detektionsprocessen. Kredit:HKBU Et forskerhold fra Institut for Kemi ved Hong Kong Baptist University (HKBU) har opfundet en bærbar enhed til one-stop-detektion af blykoncentrati
Ny enhed til hurtig og præcis detektering af blyDiagrammet viser detektionsprocessen. Kredit:HKBU Et forskerhold fra Institut for Kemi ved Hong Kong Baptist University (HKBU) har opfundet en bærbar enhed til one-stop-detektion af blykoncentrati -
 Bæredygtighed og effektivitet:de nye tendenser, der driver plastindustrienPlastøkonomien skal blive cirkulær. Kredit:Fraunhofer UMSICHT Med en samlet arbejdsstyrke på næsten 300, 000 ansatte, plast er en af Tysklands største industrisektorer. Industrien har også en st
Bæredygtighed og effektivitet:de nye tendenser, der driver plastindustrienPlastøkonomien skal blive cirkulær. Kredit:Fraunhofer UMSICHT Med en samlet arbejdsstyrke på næsten 300, 000 ansatte, plast er en af Tysklands største industrisektorer. Industrien har også en st
- Forskere udvikler en ny tilgang til enkeltskudskarakterisering af ultrakorte frielektronlaserimpulse…
- Den type væv, der understøtter og binder Bodys Structures
- Hvordan stimulusdollar bruges, vil påvirke emissionerne i årtier
- Ubrugte bygninger vil skabe gode boliger i COVID-19-verdenen
- Hvad er ioniseringsnebula?
- Kun 10 flodsystemer bidrager med op til 95 procent plast i oceaner


