Hvilke intermolekylære kræfter beskriver bedst, hvorfor molekyler som CF3CF3 er opløselige i flydende CO2?
Her er hvorfor:
* Begge CF 3 Jf. 3 og Co 2 er ikke -polære molekyler. Dette betyder, at de ikke har nogen permanente dipoler, og deres primære intermolekylære interaktioner er London -spredningskræfter.
* London -spredningskræfter stammer fra midlertidige udsving i elektronfordeling omkring et molekyle, hvilket skaber midlertidige dipoler. Disse midlertidige dipoler kan derefter inducere dipoler i nærliggende molekyler, hvilket fører til svage attraktioner.
* Styrken i London -spredningskræfter afhænger af størrelsen og formen på molekylet. Større, mere polariserbare molekyler har stærkere London -spredningskræfter.
* Begge CF 3 Jf. 3 og Co 2 er relativt små molekyler, men de er begge meget polariserbare på grund af tilstedeværelsen af fluoratomer. Dette betyder, at de kan opleve relativt stærke London -spredningskræfter med hinanden, så de kan opløses i hinanden.
Andre faktorer, der skal overvejes:
* tryk: Opløseligheden af gasser i væsker øges generelt med tryk. Superkritisk co 2 , som er co 2 Ved et højt tryk og temperatur er det et almindeligt opløsningsmiddel for ikke -polære forbindelser.
* Temperatur: Opløselighed falder generelt med stigende temperatur. Der er dog undtagelser, især når man beskæftiger sig med superkritiske væsker.
Kortfattet: Mens andre intermolekylære kræfter kan spille en mindre rolle, er den primære kraft, der er ansvarlig for opløseligheden af CF 3 Jf. 3 I Liquid Co 2 er London Dispersion Forces.
Sidste artikelHvad er åh i kemi?
Næste artikelOpløses hydrofobe molekyler i vand?
 Varme artikler
Varme artikler
-
 Forskere udforsker brugen af nye materialer til at skabe mere effektive solcellerPostdoc-forsker Sarah Wieghold og adjunkt Lea Nienhaus leder efter måder at skabe bedre solceller, der kan bruge infrarødt lys. Kredit:Florida State University Et team af forskere fra Florida Stat
Forskere udforsker brugen af nye materialer til at skabe mere effektive solcellerPostdoc-forsker Sarah Wieghold og adjunkt Lea Nienhaus leder efter måder at skabe bedre solceller, der kan bruge infrarødt lys. Kredit:Florida State University Et team af forskere fra Florida Stat -
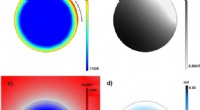 Udvikling af 3-D partikelmodel for enkeltpartikler i batterielektroderElektrokemiske fænomener inde i en enkelt partikel forudsagt ved hjælp af den udviklede model. a) Opladet tilstand; b) Elektrisk potentiale; c) Lithiumkoncentration; d) Spænding. Kredit:DGIST Der
Udvikling af 3-D partikelmodel for enkeltpartikler i batterielektroderElektrokemiske fænomener inde i en enkelt partikel forudsagt ved hjælp af den udviklede model. a) Opladet tilstand; b) Elektrisk potentiale; c) Lithiumkoncentration; d) Spænding. Kredit:DGIST Der -
 Syntetisere en ny klasse af bio-inspirerede, lysfangende nanomaterialerPOSS-peptoidmolekyler samler sig selv til rombeformede nanokrystaller. Kredit:Stephanie King | Pacific Northwest National Laboratory Inspireret af naturen, forskere ved Pacific Northwest National
Syntetisere en ny klasse af bio-inspirerede, lysfangende nanomaterialerPOSS-peptoidmolekyler samler sig selv til rombeformede nanokrystaller. Kredit:Stephanie King | Pacific Northwest National Laboratory Inspireret af naturen, forskere ved Pacific Northwest National -
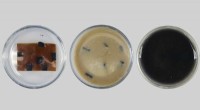 Designermaterialer til at holde plastik ude af lossepladserTo forskellige PDK-plast i sur opløsning, der viser, hvordan hver polymer let nedbrydes til individuelle monomerer i forskellige trin udført ved forskellige temperaturer, hvilket giver mulighed for fu
Designermaterialer til at holde plastik ude af lossepladserTo forskellige PDK-plast i sur opløsning, der viser, hvordan hver polymer let nedbrydes til individuelle monomerer i forskellige trin udført ved forskellige temperaturer, hvilket giver mulighed for fu
- Forskning finder, at mekanisk drevet kemi accelererer reaktioner i sprængstoffer
- Er Venus vulkansk aktiv? Ny tilgang kunne give et svar
- De økonomiske omkostninger ved klimaændringer kan være seks gange højere end tidligere antaget
- Forskere åbner ny jord inden for trådløs energigenerering til fremtidige elektroniske gadgets
- Eleven laver en bærbar tegnebog for at holde medicinen kølig efter at være blevet inspireret af v…
- Hvordan forbliver skyer på himlen?


