Hvordan nogle opløste stoffer reagerer på et opløsningsmiddel?
1. Opløsning:
* polære opløste stoffer i polære opløsningsmidler: Dette er det klassiske tilfælde af "som opløser som". Polære opløste stoffer (som sukker eller salt) opløses let i polære opløsningsmidler (som vand). De stærke dipol-dipol-interaktioner mellem opløsningsmidlet og opløst molekyler fører til dannelse af opløsningsskaller, hvilket effektivt trækker opløsningen fra hinanden og spreder det gennem opløsningsmidlet.
* Ikke-polære opløste stoffer i ikke-polære opløsningsmidler: Tilsvarende opløses ikke-polære opløste stoffer (som olie eller fedt) i ikke-polære opløsningsmidler (som benzin). De svage London -spredningskræfter mellem molekylerne er nok til at muliggøre blanding.
2. Interaktioner ud over enkel opløsning:
* ioniske forbindelser i vand: Ioniske forbindelser som NaCl dissocieres i deres respektive ioner (Na+ og Cl-), når de opløstes i vand. De polære vandmolekyler omgiver ionerne, danner hydratiseringsskaller og holder dem adskilt.
* syrer og baser: Syrer og baser gennemgår specifikke reaktioner med vand, hvilket fører til dannelse af henholdsvis hydronium (H3O+) eller hydroxid (OH-) ioner. Dette ændrer pH i opløsningen.
* Kompleks dannelse: Visse opløste stoffer kan danne komplekser med opløsningsmiddelmolekylerne. For eksempel kan overgangsmetalioner danne komplekser med vandmolekyler og ændre farven på opløsningen.
3. Uopløselige opløste stoffer:
* olie og vand: Olie og vand blandes ikke, fordi de stærke brintbindinger i vand er meget stærkere end de svage London -spredningskræfter mellem olie- og vandmolekyler. Dette fører til en adskillelse af faser.
Faktorer, der påvirker opløselighed:
* Temperatur: Generelt øger stigende temperaturopløselighed for de fleste faste stoffer og gasser.
* tryk: Tryk påvirker opløseligheden af gasser, hvilket øger opløseligheden, når trykket øges.
* arten af opløst stof og opløsningsmiddel: Som nævnt ovenfor spiller polariteten og andre egenskaber ved opløst stof og opløsningsmiddel en vigtig rolle.
Nøglekoncepter:
* Polaritet: Henviser til fordelingen af ladning inden for et molekyle. Polære molekyler har en positiv og negativ ende, mens ikke-polære molekyler har en mere jævn fordeling af ladning.
* Intermolekylære kræfter: Kræfterne til tiltrækning mellem molekyler. Jo stærkere kræfterne er, desto mere sandsynligt vil et opløst stof opløses i et opløsningsmiddel.
* solvation: Processen med opløste molekyler er omgivet af opløsningsmiddelmolekyler.
At forstå interaktionerne mellem opløste stoffer og opløsningsmidler er afgørende inden for mange områder, herunder kemi, biologi og teknik. Det hjælper os med at forudsige opførsel af løsninger, designe nye materialer og forstå biologiske processer.
 Varme artikler
Varme artikler
-
 Forskere undersøger måder at fjerne antibiotika, der forurener søer og floderJian Wang, CLS stråleforsker; Catherine Hui Niu, U af S lektor; Bei Yan, medlem af Nius forskerhold. Kredit:University of Saskatchewan Medicin, herunder antibiotika, er en stadig mere almindelig f
Forskere undersøger måder at fjerne antibiotika, der forurener søer og floderJian Wang, CLS stråleforsker; Catherine Hui Niu, U af S lektor; Bei Yan, medlem af Nius forskerhold. Kredit:University of Saskatchewan Medicin, herunder antibiotika, er en stadig mere almindelig f -
 Børns modvilje mod blomkål, broccoli kunne skrives i deres mikrobiomKredit:CC0 Public Domain Mange børn, såvel som voksne, kan ikke lide Brassica grøntsager, såsom broccoli, blomkål, kål og rosenkål. I munden, enzymer fra disse grøntsager og fra bakterier i spyt
Børns modvilje mod blomkål, broccoli kunne skrives i deres mikrobiomKredit:CC0 Public Domain Mange børn, såvel som voksne, kan ikke lide Brassica grøntsager, såsom broccoli, blomkål, kål og rosenkål. I munden, enzymer fra disse grøntsager og fra bakterier i spyt -
 Forskere skaber holdbare, vaskbar tekstilbelægning, der kan afvise virusEn illustration viser det behandlede tekstils evne til at afvise væsker. Kredit:University of Pittsburgh Masker, kjoler, og andet personligt beskyttelsesudstyr (PPE) er afgørende for at beskytte s
Forskere skaber holdbare, vaskbar tekstilbelægning, der kan afvise virusEn illustration viser det behandlede tekstils evne til at afvise væsker. Kredit:University of Pittsburgh Masker, kjoler, og andet personligt beskyttelsesudstyr (PPE) er afgørende for at beskytte s -
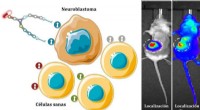 Syntetiske molekyler leverer lægemidler direkte til neuroblastomcellerKredit:Angewandte Chemie-International Edition 58 (2019) Forskere fra Universidad Politécnica de Madrid er involveret i udviklingen af specifikke molekylære stilladser, som er i stand til at lev
Syntetiske molekyler leverer lægemidler direkte til neuroblastomcellerKredit:Angewandte Chemie-International Edition 58 (2019) Forskere fra Universidad Politécnica de Madrid er involveret i udviklingen af specifikke molekylære stilladser, som er i stand til at lev


