Kan et solidt opløst stof opløses i en vandig opløsning?
Her er hvorfor:
* vandig løsning: Dette betyder, at opløsningsmidlet er vand (H₂O).
* opløste: Denne proces involverer opløste partikler (faste i dette tilfælde), der adskiller sig fra hinanden og bliver omgivet af opløsningsmiddelmolekyler (vand).
hvordan det fungerer:
1. attraktion: Vandmolekylerne har en polær struktur (positive og negative ender). De tiltrækkes af de opløste partikler, som enten kan være polære eller ioniske.
2. Omgivende: Vandmolekylerne omgiver de opløste partikler og trækker dem effektivt væk fra den faste struktur.
3. Løsning: Hvis de attraktive kræfter mellem vandmolekylerne og de opløste partikler er stærkere end kræfterne, der holder opløsningen sammen, opløses det faste stof.
Eksempler:
* salt (NaCl) opløste i vand: De ioniske bindinger i salt er brudt, og natrium (Na+) og chlorid (Cl-) ioner er omgivet af vandmolekyler.
* sukker (c₁₂h₂₂o₁₁) Opløsning i vand: De polære sukkermolekyler danner hydrogenbindinger med vandmolekyler og trækker dem i opløsning.
Vigtig note: Ikke alle faste stoffer opløses i vand. Opløseligheden af en solid afhænger af flere faktorer, herunder:
* Polaritet af opløstelsen: Polære og ioniske opløste stoffer er mere tilbøjelige til at opløses i vand.
* Temperatur: Forøgelse af temperaturen øger normalt opløselighed.
* tryk: Tryk har en ubetydelig effekt på opløseligheden af faste stoffer i væsker.
Sidste artikelHvad er det kemiske navn på sammensat C6H12O6?
Næste artikelHvad indeholder atomkernen?
 Varme artikler
Varme artikler
-
 Konstruere et polymernetværk til at fungere som aktiv camouflage efter behovForskernes kunstige kromatoforer består af membraner strakt over cirkulære hulrum fastgjort til pneumatiske pumper. Tryk på hulrummet strækker membranen, ændre tonehøjden for den spiralformede flydend
Konstruere et polymernetværk til at fungere som aktiv camouflage efter behovForskernes kunstige kromatoforer består af membraner strakt over cirkulære hulrum fastgjort til pneumatiske pumper. Tryk på hulrummet strækker membranen, ændre tonehøjden for den spiralformede flydend -
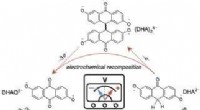 Forskning forlænger levetiden for molekyler i organiske flow-batterier til praktiske værdierFlowbatteriets cyklus. Når molekylet nedbrydes under regelmæssig cykling, kan det genoplives ved, at det skaber en spændingsimpuls, der nulstiller de nedbrydende molekyler tilbage til deres oprindelig
Forskning forlænger levetiden for molekyler i organiske flow-batterier til praktiske værdierFlowbatteriets cyklus. Når molekylet nedbrydes under regelmæssig cykling, kan det genoplives ved, at det skaber en spændingsimpuls, der nulstiller de nedbrydende molekyler tilbage til deres oprindelig -
 Radial syntese bryder ny vej for kemisk forskning og produktionEn reaktor til alle formål:På Max Planck Institute of Colloids and Interfaces, et team ledet af Kerry Gilmore og Peter Seeberger har udviklet en automatiseret maskine til radial syntese. Reaktorens hj
Radial syntese bryder ny vej for kemisk forskning og produktionEn reaktor til alle formål:På Max Planck Institute of Colloids and Interfaces, et team ledet af Kerry Gilmore og Peter Seeberger har udviklet en automatiseret maskine til radial syntese. Reaktorens hj -
 Video:Hvordan hårfarve virkerKredit:The American Chemical Society Uanset om du har brug for en forklædning for at løbe fra loven eller bare prøver at efterligne *NSYNC-tidens frostede tip, du kan få brug for noget kemisk assi
Video:Hvordan hårfarve virkerKredit:The American Chemical Society Uanset om du har brug for en forklædning for at løbe fra loven eller bare prøver at efterligne *NSYNC-tidens frostede tip, du kan få brug for noget kemisk assi
- Energikrise:Hvordan EU håber at tackle høje elpriser og samtidig beskytte sit grænseoverskridende…
- Caravansamfund:Ældre, underforsikret og overeksponeret for cykloner, storme og katastrofer
- Ændrer tilsætning af salt opdriften i almindeligt vand?
- Hvad er kommerciel dyrkning?
- Hvilken flyby -satellit, der blev lanceret af USA, opdagede et andet strålingsbælte omkring Jorden…
- Ny teknik kaster lys over kropssprog i jobsamtaler, salgsopkald, team projekter


