Hvilken slags krystaller absorberer vanddamp fra luften?
Her er nogle eksempler på hygroskopiske krystaller:
* natriumchlorid (NaCl): Bordsalt er let hygroskopisk, hvilket betyder, at det tiltrækker vandmolekyler fra luften, især i fugtige miljøer. Dette er grunden til, at salt kan blive klumpet over tid.
* Calciumchlorid (CACL2): Dette er et meget hygroskopisk salt, der ofte bruges som et tørremiddel (tørringsmiddel). Det absorberer vand fra luften, hvilket gør det nyttigt til udtørring af rum eller materialer.
* kaliumhydroxid (KOH): Dette er en stærk base, der er meget hygroskopisk og kan endda absorbere nok vand til at opløse sig selv.
* magnesiumsulfat (MGSO4): Denne forbindelse, der ofte findes i Epsom -salte, er hygroskopisk og bruges ofte til tørringsanvendelser.
Vigtig note: Mens disse krystaller tiltrækker og holder vandmolekyler, "absorberer de ikke bogstaveligt talt dem på samme måde som en svamp gør. Vandmolekylerne er mere som tiltrukket og holdes på krystalens overflade.
Yderligere læsning:
* Hygroskopisk: )
* tørremidler: )
Sidste artikelHvorfor opstår nukleare reaktioner?
Næste artikelHvad er forskellen mellem emission og absorption?
 Varme artikler
Varme artikler
-
 Plast glukose-drevet biosensor finder sød succesEt skematisk billede af biobrændselscellen i helt polymer, som trækker energi fra den glukose, der naturligt findes i spyt. Kredit:© 2019 KAUST; Heno Hwang En elektronisk biosensor drevet af gluko
Plast glukose-drevet biosensor finder sød succesEt skematisk billede af biobrændselscellen i helt polymer, som trækker energi fra den glukose, der naturligt findes i spyt. Kredit:© 2019 KAUST; Heno Hwang En elektronisk biosensor drevet af gluko -
 Sådan får du ledende geler til at klæbe, når de er våde(A) Billede af en lap-shear test opsætning. Billedkredit:Hyunwoo Yuk, MIT. (B) Billede af klæbemiddelsvigt under en lap-shear test af en våd PEDOT:PSS klæbet på et uberørt glas eller et uberørt glas m
Sådan får du ledende geler til at klæbe, når de er våde(A) Billede af en lap-shear test opsætning. Billedkredit:Hyunwoo Yuk, MIT. (B) Billede af klæbemiddelsvigt under en lap-shear test af en våd PEDOT:PSS klæbet på et uberørt glas eller et uberørt glas m -
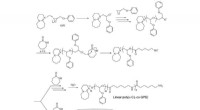 Nye klæbende og termisk stabile epoxyharpikserKredit:Kansai University Epoxyharpikser eller epoxyer er organiske forbindelser, der kan hærdes til klæbende materialer med fremragende termisk stabilitet, mekanisk styrke, og kemisk resistens. Hæ
Nye klæbende og termisk stabile epoxyharpikserKredit:Kansai University Epoxyharpikser eller epoxyer er organiske forbindelser, der kan hærdes til klæbende materialer med fremragende termisk stabilitet, mekanisk styrke, og kemisk resistens. Hæ -
 Registrering af giftig PFAS med en sensor i chipstørrelseEn illustration af PNNLs PFAS -sensor. Vandprøver strømmer i den ene ende, gennem labyrinten, og PFOS bliver fanget af et svampelignende materiale i midten. Teknologien er tilgængelig for licensudsted
Registrering af giftig PFAS med en sensor i chipstørrelseEn illustration af PNNLs PFAS -sensor. Vandprøver strømmer i den ene ende, gennem labyrinten, og PFOS bliver fanget af et svampelignende materiale i midten. Teknologien er tilgængelig for licensudsted
- I hvilken bjergkæde finder Rhine Rhone Po og Donau Rivers deres kilder?
- SAT Math Prep II: Eksponenter, Nøgletal og Procenter
- Hvordan sker magnetisk vending?
- Borophenes gjort let
- Ikke-detektering af nøglesignal gør det muligt for astronomer at bestemme, hvad de første galakse…
- 'Søer' under Mars' sydpol:Et mudret billede?


