Hvilket af følgende sammenligner korrekt svovlisotoper 32s og 35s?
* isotoper er atomer med det samme element (i dette tilfælde svovl), der har det samme antal protoner, men forskellige antal neutroner.
* 32S har 16 protoner og 16 neutroner (32 - 16 =16).
* 35s har 16 protoner og 19 neutroner (35 - 16 =19).
Her er en sammenligning:
* atomnummer: Begge isotoper har det samme atomnummer (16), hvilket betyder, at de begge er svovl.
* Massenummer: 35s er tungere end 32'erne, fordi det har yderligere tre neutroner.
* Kemiske egenskaber: Isotoper af det samme element har meget lignende kemiske egenskaber. De vil reagere på samme måde, men nogle subtile forskelle kan forekomme på grund af forskellen i masse.
* stabilitet: 32S er den mest stabile isotop af svovl, mens 35S er radioaktiv og gennemgår beta -forfald.
Derfor er den mest markante forskel mellem 32S og 35S deres masseantal og stabilitet. 35s er tungere og radioaktivt, mens 32S er lettere og stabil.
 Varme artikler
Varme artikler
-
 Hvordan bakterier producerer manganoxid-nanopartiklerForskere studerede strukturen af et rekombinant enzym, der er ansvarlig for biomineralisering af Mn, give ledetråde til potentiel miljøsanering eller bioenergiproduktion. Kredit:Environmental Molecu
Hvordan bakterier producerer manganoxid-nanopartiklerForskere studerede strukturen af et rekombinant enzym, der er ansvarlig for biomineralisering af Mn, give ledetråde til potentiel miljøsanering eller bioenergiproduktion. Kredit:Environmental Molecu -
 Højteknologisk udskrivning kan hjælpe med at eliminere smertefulde skudMicroneedle array har bagudvendte modhager, der låser sig med væv, når de indsættes, forbedre vedhæftningen. Kredit:Riddish Morde Smertefulde injektionsnåle er muligvis ikke nødvendige i fremtiden
Højteknologisk udskrivning kan hjælpe med at eliminere smertefulde skudMicroneedle array har bagudvendte modhager, der låser sig med væv, når de indsættes, forbedre vedhæftningen. Kredit:Riddish Morde Smertefulde injektionsnåle er muligvis ikke nødvendige i fremtiden -
 Teknologi gør smartphones til on-the-spot detektorer for fødevarebårne sygdomme, andre farlige fo…Purdue teknologi, inklusive en smartphone-holder, gør telefoner til on-the-spot detektorer for fødevarebårne sygdomme. Kredit:Purdue University Purdue University forskere har udviklet detektionste
Teknologi gør smartphones til on-the-spot detektorer for fødevarebårne sygdomme, andre farlige fo…Purdue teknologi, inklusive en smartphone-holder, gør telefoner til on-the-spot detektorer for fødevarebårne sygdomme. Kredit:Purdue University Purdue University forskere har udviklet detektionste -
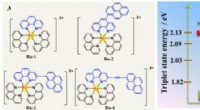 Finjustering af den exciterede tilstand af Ru(II)-fotosensibilisatorer til at øge kuldioxidomdannel…(Venstre) Molekylær struktur af Ru-1-Ru-4. (Højre) Energidiagram over triplettilstande af Ru-1, og L-2-L-4. Kredit:©Science China Press Soldrevet reduktion af CO 2 til energirige brændstoffer, s
Finjustering af den exciterede tilstand af Ru(II)-fotosensibilisatorer til at øge kuldioxidomdannel…(Venstre) Molekylær struktur af Ru-1-Ru-4. (Højre) Energidiagram over triplettilstande af Ru-1, og L-2-L-4. Kredit:©Science China Press Soldrevet reduktion af CO 2 til energirige brændstoffer, s
- Adgangen til job med transit øges i mange amerikanske metroer
- Hvordan Facebook skred – i nøglepunkter
- Hvad er det buede overfladeareal i en cylinderlængde 12 cm og diameter 8 cm?
- Hvor mange newton er 5,75 kg?
- For sød til at modstå:Får finurlige produkter forbrugerne til at bruge for meget?
- Hvad er de otte vigtigste økosystemer?


