Hvordan er brominer atomradius sammenlignet med arsen?
* Periodiske tendenser: Atomradius øges generelt, når du bevæger dig ned ad en gruppe (kolonne) af den periodiske tabel og falder, når du bevæger dig over en periode (række) fra venstre mod højre.
* placering på den periodiske tabel: Brom er placeret i gruppe 17 (halogener) og arsen er i gruppe 15 (pnictogener). Begge er i samme periode (periode 4).
* Effektiv nuklearafgift: Brom har en højere effektiv nuklearafgift (den nettopositive ladning, der opleves af en elektron) end arsen. Dette skyldes, at brom har flere protoner i sin kerne, trækker dens elektroner tættere og resulterer i en mindre atomradius.
Kortfattet: Selvom brom og arsen er i samme periode, fører bromens højere effektive atomafgift på grund af dets større antal protoner til en mindre atomradius.
Sidste artikelEr CH3BR et polært eller ikke -molekyle?
Næste artikelHvor mange mol er i 2.16 10 til de 24 effektatomer af bly?
 Varme artikler
Varme artikler
-
 Forskere udvikler metode, der kan producere stærkere, mere bøjelige metallerKredit:Brigham Young University Det er måske ikke så iørefaldende som kæder og svage led, men fysikere og ingeniører ved et materiale er kun så stærkt som dets svageste korngrænse. OKAY, det er s
Forskere udvikler metode, der kan producere stærkere, mere bøjelige metallerKredit:Brigham Young University Det er måske ikke så iørefaldende som kæder og svage led, men fysikere og ingeniører ved et materiale er kun så stærkt som dets svageste korngrænse. OKAY, det er s -
 Ny kobberbelægning kunne blive den næste superbug fighterKredit:Pixabay/CC0 Public Domain En ny kobberbelægning, der dræber bakterier hurtigere og i større mængder end de nuværende formuleringer, kan snart være tilgængelig for hospitaler og andre højtraf
Ny kobberbelægning kunne blive den næste superbug fighterKredit:Pixabay/CC0 Public Domain En ny kobberbelægning, der dræber bakterier hurtigere og i større mængder end de nuværende formuleringer, kan snart være tilgængelig for hospitaler og andre højtraf -
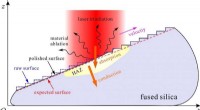 CO2 -laserablation fører en ny vej til skræddersyede kontinuerlige smeltede silicaoverfladerFigur 1. Skematisk diagram for 2-D numerisk model af CO 2 laserablation. Kredit:SIOM Smeltet silica er et vigtigt materiale til mange anvendelser inden for optik og fotonik på grund af dets frem
CO2 -laserablation fører en ny vej til skræddersyede kontinuerlige smeltede silicaoverfladerFigur 1. Skematisk diagram for 2-D numerisk model af CO 2 laserablation. Kredit:SIOM Smeltet silica er et vigtigt materiale til mange anvendelser inden for optik og fotonik på grund af dets frem -
 Forlængelse af fødevarers holdbarhed med nanomaterialerKredit:Ozgur Coskun, Shutterstock Hvornår var sidste gang du blev fristet af lækre kirsebær i dit supermarked eller så, at dit yndlingsmærke af emballeret brød var til salg, og du har grådigt købt
Forlængelse af fødevarers holdbarhed med nanomaterialerKredit:Ozgur Coskun, Shutterstock Hvornår var sidste gang du blev fristet af lækre kirsebær i dit supermarked eller så, at dit yndlingsmærke af emballeret brød var til salg, og du har grådigt købt
- Undersøgelse viser, at avisartikler skifter mening
- Forbedret energi:Team søger mere kraftfulde elektroniske enheder
- Hvilke tidevand produceres, når solmåne og jorden helt i kø?
- Hvorfor vi skal blive bedre til at forudsige rumvejr
- Hvad er solen, og hvad den gjorde af?
- Enestående 3D-billeder af levende celler plus detaljer om molekyler indeni


