Hvorfor har elementerne kalium og natrium lignende kemiske egenskaber?
* Elektronkonfiguration: Både kalium og natrium har et enkelt elektron i deres yderste skal (valenselektron). Denne enkelt elektron holdes relativt løst og mistes let, hvilket gør dem meget reaktive.
* tendens til at danne kationer: Tabet af denne enkelt valenselektron resulterer i dannelsen af en +1 -ion (kation). Både kalium og natrium danner let kationer, hvorfor de er meget reaktive med ikke -metaller.
* Lignende reaktivitet: På grund af den lignende elektronkonfiguration og let at danne kationer, reagerer begge elementer kraftigt med vand, ilt og halogener. Deres reaktioner frigiver ofte betydelige mængder energi.
Kortfattet:
* gruppe 1 (alkalimetaller): Alle elementer i denne gruppe deler karakteristikken ved at have en valenselektron, hvilket fører til lignende kemisk opførsel.
* reaktivitet: Tendensen til at miste deres valenselektron gør dem meget reaktive med egenskaber inklusive:
* Kraftig reaktion med vand
* Dannelse af ioniske forbindelser med ikke -metaller
* Let oxidation
Fortæl mig, hvis du gerne vil gå dybere ned i et specifikt aspekt af deres kemi!
Sidste artikelHvilken farve er flammen, når du forbrænder kobber II -klorid?
Næste artikelHvor mange atomer er til stede i 16 g iltgas?
 Varme artikler
Varme artikler
-
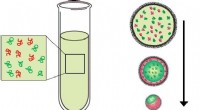 Cellestørrelse regulerer molekylær adskillelseVandig opløsning af to polymerer (rød og grøn) i et reagensglas og i kunstige celler af forskellig størrelse. I reagensglasset blandes opløsningen homogent, men i den lille kunstige celle skilles oplø
Cellestørrelse regulerer molekylær adskillelseVandig opløsning af to polymerer (rød og grøn) i et reagensglas og i kunstige celler af forskellig størrelse. I reagensglasset blandes opløsningen homogent, men i den lille kunstige celle skilles oplø -
 Tilpasning af partikelstørrelserne af Pt₅Ce-legering nanopartikler til oxygenreduktionsreaktionenIfølge forskellige mekanismer for partikelvæksten er synteseprocessen opdelt i tre sekventielle perioder, nemlig periode 1, hvor Pt4+ ioner reduceres til Pt-nanopartikler; Periode 2, hvor Pt-nanoparti
Tilpasning af partikelstørrelserne af Pt₅Ce-legering nanopartikler til oxygenreduktionsreaktionenIfølge forskellige mekanismer for partikelvæksten er synteseprocessen opdelt i tre sekventielle perioder, nemlig periode 1, hvor Pt4+ ioner reduceres til Pt-nanopartikler; Periode 2, hvor Pt-nanoparti -
 En enklere model kommer til sagen med proteinerCecilia Clementi. Kredit:Jeff Fitlow/Rice University Beregningsmodeller er kommet langt i deres evne til at simulere de mest basale biologiske processer, såsom hvordan proteiner folder. En ny tekn
En enklere model kommer til sagen med proteinerCecilia Clementi. Kredit:Jeff Fitlow/Rice University Beregningsmodeller er kommet langt i deres evne til at simulere de mest basale biologiske processer, såsom hvordan proteiner folder. En ny tekn -
 Hurtigere og billigere ethanol-til-jet-brændstof i horisontenRobert Dagle har et hætteglas med brændstof skabt fra biomassekonvertering. Kredit:Andrea Starr |Pacific Northwest National Laboratory En patenteret proces til omdannelse af alkohol, der stammer f
Hurtigere og billigere ethanol-til-jet-brændstof i horisontenRobert Dagle har et hætteglas med brændstof skabt fra biomassekonvertering. Kredit:Andrea Starr |Pacific Northwest National Laboratory En patenteret proces til omdannelse af alkohol, der stammer f
- Sådan beregnes QCAL
- Miljøvenlige solceller forbedrer energiproduktionseffektiviteten ved at løse defekter
- Hvordan dannes der materie?
- Nanolegeringer 10 gange så effektive som ren platin i brændselsceller
- Navnet på væsken i menneskets øre?
- Kasserede pandemiske ansigtsmasker kan skade dyrelivet i de kommende år


