Ser du på et frit energi -diagram for en ligevægtsreaktion, hvilken af følgende scenarier vil favorisere dannelse mere reaktant?
Gratis energi diagrammer
* fri energi (g): Den lodrette akse repræsenterer systemets Gibbs frie energi.
* reaktionsprogrammer: Den vandrette akse repræsenterer reaktionens fremskridt og bevæger sig fra reaktanter til venstre til produkter til højre.
* Overgangstilstand: Toppen af diagrammet repræsenterer overgangstilstanden, det højeste energipunkt under reaktionen.
* ΔG (ændring i fri energi): Forskellen i fri energi mellem reaktanter og produkter. En negativ ΔG indikerer en spontan reaktion, der favoriserer produktdannelse. En positiv ΔG indikerer en ikke-spontan reaktion, der favoriserer reaktantdannelse.
Scenarier, der favoriserer reaktanter
Her er scenarierne, der vil favorisere dannelsen af flere reaktanter i en ligevægtsreaktion, baseret på et gratis energi diagram:
1. positiv ΔG (fri energiændring): Hvis produkternes frie energi er højere end reaktanternes frie energi (ΔG er positiv), er reaktionen ikke-spontan. Dette betyder, at systemet vil favorisere reaktanterne.
2. Høj aktiveringsenergi: En meget høj aktiveringsenergi (forskellen i energi mellem reaktanterne og overgangstilstanden) vil gøre det vanskeligt for reaktionen at fortsætte. Dette bremser effektivt den fremadgående reaktion og favoriserer reaktanterne.
3. Stor forskel i fri energi mellem reaktanter og produkter: Selv hvis ΔG er negativ (favoriserer produkter), vil en meget stor forskel i fri energi mellem reaktanter og produkter skifte ligevægt stærkt mod produkterne. Dette betyder, at ligevægtskonstanten (K) vil være meget stor, og koncentrationen af reaktanter vil være meget lav.
Kortfattet:
* en positiv ΔG favoriserer altid reaktanter.
* En høj aktiveringsenergi kan hindre den fremadrettede reaktion og også favorisere reaktanter.
* En stor forskel i fri energi mellem reaktanter og produkter, selvom de er negative, kan resultere i meget lave reaktantkoncentrationer.
Eksempel:
Overvej en reaktion med en ΔG på +10 kJ/mol. Dette betyder, at produkterne har en højere fri energi end reaktanterne. Ligevægten ligger stærkt på siden af reaktanterne.
Fortæl mig, hvis du gerne vil udforske et specifikt eksempel eller have yderligere spørgsmål!
Sidste artikelHvad hedder sammensat C2H5COCL?
Næste artikelHvad er udgangsmaterialet i en kemisk reaktion?
 Varme artikler
Varme artikler
-
 Geometrisk forvirrende kvasikrystaller fundet i resterne af den første atomsprængning nogensindeVarmen og trykket fra en atomeksplosion kan frembringe usædvanlige kemiske kuriositeter. Kredit:United States Department of Energy/wikimedia Nukleare detonationer udløser en forbløffende mængde de
Geometrisk forvirrende kvasikrystaller fundet i resterne af den første atomsprængning nogensindeVarmen og trykket fra en atomeksplosion kan frembringe usædvanlige kemiske kuriositeter. Kredit:United States Department of Energy/wikimedia Nukleare detonationer udløser en forbløffende mængde de -
 Reduktion muliggør renere og mere effektive katalytiske reaktionerKredit:Tokyo Institute of Technology I et løbende forsøg på at fremskynde katalytiske reaktioner, oxidation af metalkomplekser ved hjælp af lys er dukket op som en standardmetode til at syntetiser
Reduktion muliggør renere og mere effektive katalytiske reaktionerKredit:Tokyo Institute of Technology I et løbende forsøg på at fremskynde katalytiske reaktioner, oxidation af metalkomplekser ved hjælp af lys er dukket op som en standardmetode til at syntetiser -
 Metode til at anvende mikrofluidiske elektrokemiske teknologier til redox-neutrale reaktioner med en…Baggrund og mikrofluidisk redox-neutral elektrokemi (μRN-eChem). Kredit: Videnskab (2020). DOI:10.1126/science.aba3823 Et team af kemikere og ingeniører ved MIT har fundet en ny måde at anvende m
Metode til at anvende mikrofluidiske elektrokemiske teknologier til redox-neutrale reaktioner med en…Baggrund og mikrofluidisk redox-neutral elektrokemi (μRN-eChem). Kredit: Videnskab (2020). DOI:10.1126/science.aba3823 Et team af kemikere og ingeniører ved MIT har fundet en ny måde at anvende m -
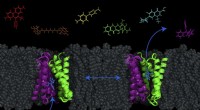 Ny model afslører muligheden for at pumpe antibiotika ind i bakterierEt transportørprotein - kaldet EmrE, vist i lilla og grønt -- i cellemembranen af E. coli kan bakterier skiftes mellem to konformationer for at pumpe molekyler (såsom antibakterielle lægemidler) ud
Ny model afslører muligheden for at pumpe antibiotika ind i bakterierEt transportørprotein - kaldet EmrE, vist i lilla og grønt -- i cellemembranen af E. coli kan bakterier skiftes mellem to konformationer for at pumpe molekyler (såsom antibakterielle lægemidler) ud
- Hvad er den forskellige videnskab og sundhed?
- Forskning undersøger vingeformer for at reducere hvirvel og vågenhed
- Kan vi styre vejret?
- Måske er ultravarme Jupiters alligevel ikke så dømt
- Boeing 1 måned ud fra 4 års catchup til SpaceX med 1. bemandede Starliner-flyvning
- Solsystemer kan bruges som ressourcer til planteproduktivitet, undersøgelse viser


