Former svovl og ilt ioniske forbindelser?
Her er hvorfor:
* Elektronegativitet: Oxygen er meget elektronegativ, hvilket betyder, at det har en stærk attraktion for elektroner. Svovl er også elektronegativ, men mindre end ilt. Forskellen i elektronegativitet mellem de to elementer er ikke stor nok til at skabe en komplet overførsel af elektroner, hvilket er nødvendigt for en ionisk binding.
* Bonding Natur: I stedet for at overføre elektroner deler svovl og iltelektroner til dannelse af kovalente bindinger. Denne deling skaber et mere stabilt arrangement for begge atomer.
Eksempler på svovl-iltforbindelser inkluderer:
* svovldioxid (SO₂)
* svovltrioxid (SO₃)
* svovlsyre (h₂so₄)
Disse forbindelser holdes alle sammen af kovalente bindinger, ikke ioniske bindinger.
 Varme artikler
Varme artikler
-
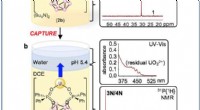 Team udvikler en elektrokemisk metode til udvinding af uran, og potentielt andre metalioner, fra lø…En illustration af den elektrokemiske koblingsmetode til at fange og frigive uranioner. Kredit:University of California - Santa Barbara For 50 år siden, videnskabsmænd ramte på, hvad de troede kun
Team udvikler en elektrokemisk metode til udvinding af uran, og potentielt andre metalioner, fra lø…En illustration af den elektrokemiske koblingsmetode til at fange og frigive uranioner. Kredit:University of California - Santa Barbara For 50 år siden, videnskabsmænd ramte på, hvad de troede kun -
 Hvis opløselighed er problemet - mekanokemi er løsningenMekanisk energi tilvejebragt ved kollisionen af fræsekugle i planetariske kuglemøller gør det muligt at syntetisere nanografenstrukturer under miljøvenlige og opløsningsmiddelfri reaktionsbetingelse
Hvis opløselighed er problemet - mekanokemi er løsningenMekanisk energi tilvejebragt ved kollisionen af fræsekugle i planetariske kuglemøller gør det muligt at syntetisere nanografenstrukturer under miljøvenlige og opløsningsmiddelfri reaktionsbetingelse -
 Edderkoppesilke kunne bruges som robotmuskelTvunget silke fra en Nephila pilipes edderkop. Kredit:Liu et al., Sci. Adv . 2019; 5:eaau9183 Edderkoppesilke, allerede kendt som et af de stærkeste materialer for sin vægt, viser sig at have en
Edderkoppesilke kunne bruges som robotmuskelTvunget silke fra en Nephila pilipes edderkop. Kredit:Liu et al., Sci. Adv . 2019; 5:eaau9183 Edderkoppesilke, allerede kendt som et af de stærkeste materialer for sin vægt, viser sig at have en -
 At bryde vandmolekyler fra hinanden for at generere rent brændstof:Undersøgelse af et lovende mate…Fotoelektrokemisk vandopdeling. Vand kan spaltes for at opnå H 2 og O. 2 ved at anvende en lav spænding i et kredsløb som det, der er vist i figuren, ved hjælp af et passende fotoanodemateriale. H
At bryde vandmolekyler fra hinanden for at generere rent brændstof:Undersøgelse af et lovende mate…Fotoelektrokemisk vandopdeling. Vand kan spaltes for at opnå H 2 og O. 2 ved at anvende en lav spænding i et kredsløb som det, der er vist i figuren, ved hjælp af et passende fotoanodemateriale. H
- Friends indflydelse hjælper teleselskaber med at fastholde kunder
- Kan AI forhindre spredning af HIV i hjemløse unge?
- Livet på kanten:Ny forskning identificerer vinderne og taberne af skovfragmentering
- Hvilken type reaktion er den sammensatte C6H12O6?
- Kunstigt sødemiddel kunne en dag give kræftbehandlinger med færre bivirkninger
- Hvor fjernes sukker fra kroppen?


