Hvilken videnskabelig konklusion kan gøres ved at kombinere kobberchlorid og aluminiumsfolie?
reaktion:
* cucl₂ (aq) + 2al (s) → 2Alcl₃ (aq) + 3cu (s)
Forklaring:
* aluminium (AL) er mere reaktiv end kobber (CU) . Dette betyder, at aluminium har en stærkere tendens til at miste elektroner og danne positive ioner.
* I reaktionen fortrænger aluminiumatomer kobberioner fra kobberchloridopløsningen.
* Aluminiumatomer mister elektroner og danner aluminiumioner (al³⁺), som derefter kombineres med chloridioner (CL⁻) for at danne aluminiumchlorid (ALCL₃).
* Kobberionerne (Cu²⁺) får elektroner og bliver kobberatomer (Cu), der udfælder ud af opløsningen som et rødbrunt fast stof.
Observationer:
* Du vil observere en farveændring i opløsningen, da den blå kobberchloridopløsning bliver klar eller lidt gullig.
* Du vil også se en rødlig-brun belægning, der dannes på aluminiumsfolien, som er det deponerede kobbermetal.
* Reaktionen er eksoterm, hvilket betyder, at den frigiver varme, og opløsningen kan føles varm.
Videnskabelig konklusion:
* Denne reaktion demonstrerer relative reaktivitet af metaller. Aluminium, der er mere reaktiv, fortrænger kobber fra dens forbindelse.
* Den enkelte forskydningsreaktion producerer en ny forbindelse (aluminiumchlorid) og et nyt element (kobber).
* Reaktionen er et klart eksempel på en redox -reaktion (Oxidationsreduktionsreaktion), hvor elektroner overføres fra aluminium til kobber.
Yderligere noter:
* Reaktionen bruges ofte i introduktionskemiske laboratorier til at demonstrere enkeltfortrængningsreaktioner og begrebet reaktivitetsserie.
* Mængden af deponeret kobber afhænger af mængden af anvendt kobberchlorid og overfladearealet af aluminiumsfolien.
* Reaktionen kan være ret kraftig, så det er vigtigt at udføre den i et sikkert miljø med passende sikkerhedsforholdsregler.
Sidste artikelHvad gør brintperoxid og sukker?
Næste artikelHvorfor gashydrater dannet i oliebrønd?
 Varme artikler
Varme artikler
-
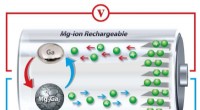 Selvhelbredende væske bringer nyt liv til batterialternativetI forskernes nye anodedesign, gallium smelter og størkner gentagne gange, helbredelse af de revner, der ellers gradvist ville mindske batteriets evne til at holde en opladning. Kredit:University of Pe
Selvhelbredende væske bringer nyt liv til batterialternativetI forskernes nye anodedesign, gallium smelter og størkner gentagne gange, helbredelse af de revner, der ellers gradvist ville mindske batteriets evne til at holde en opladning. Kredit:University of Pe -
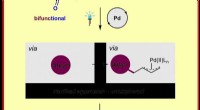 Undervisning i gamle overgangsmetaller nye tricks:Kemikere aktiverer palladiumkatalyse ved lysKemisk illustration af den nye metode til fremstilling af π-allylpalladiumkomplekser ved radikal kemi Kredit:Frank Glorius Ved fremstilling af forbindelser, kemikere har det grundlæggende mål at f
Undervisning i gamle overgangsmetaller nye tricks:Kemikere aktiverer palladiumkatalyse ved lysKemisk illustration af den nye metode til fremstilling af π-allylpalladiumkomplekser ved radikal kemi Kredit:Frank Glorius Ved fremstilling af forbindelser, kemikere har det grundlæggende mål at f -
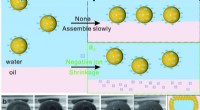 Overfladeforbedret Raman-spektroskopimetode realiserer kvantitativ påvisning af kræftlægemidler i…Figur 1. Skematisk diagram af 3D-hotspot-matrixdannelse. Kredit:Zhou Guoliang Ved at bruge den krympesamlede flydende tredimensionelle (3D) hot spot matrix som en mikroreaktor, blev en ny metode ti
Overfladeforbedret Raman-spektroskopimetode realiserer kvantitativ påvisning af kræftlægemidler i…Figur 1. Skematisk diagram af 3D-hotspot-matrixdannelse. Kredit:Zhou Guoliang Ved at bruge den krympesamlede flydende tredimensionelle (3D) hot spot matrix som en mikroreaktor, blev en ny metode ti -
 Forskere simulerer processen med klæbende slidComputersimuleringen viser klæbende slid på en selv-affin overflade. Kredit:LSMS / EPFL Overfladeslid beskriver processen med materialetab, når to overflader kommer i kontakt med hinanden. Det har
Forskere simulerer processen med klæbende slidComputersimuleringen viser klæbende slid på en selv-affin overflade. Kredit:LSMS / EPFL Overfladeslid beskriver processen med materialetab, når to overflader kommer i kontakt med hinanden. Det har


