Hvor mange gram nitrogendioxid skal reagere med vand for at producere 5,00 x 1022 molekyler monoxid?
1. Skriv den afbalancerede kemiske ligning:
3 NO₂ (G) + H₂O (L) → 2 HNO₃ (AQ) + NO (G)
2. Bestem molforholdet mellem nitrogendioxid (NO₂) og nitrogenmonoxid (NO):
Fra den afbalancerede ligning ser vi, at 3 mol NO₂ reagerer på at producere 1 mol NO.
3. Konverter molekyler af NO til mol:
* Avogadros nummer:6,022 x 10²³ molekyler/mol
* Mol NO =(5,00 x 10²² molekyler) / (6,022 x 10²³ molekyler / mol) =0,0830 mol nr.
4. Beregn mol No₂ Nødvendigt:
* Mol NO₂ =(0,0830 mol nr) * (3 mol No₂ / 1 mol nr) =0,249 mol No₂
5. Konverter mol af NO₂ til gram:
* Molmasse på NO₂ =14,01 g/mol (n) + 2 * 16,00 g/mol (O) =46,01 g/mol
* Gram No₂ =(0,249 mol No₂) * (46,01 g/mol) = 11,4 g no₂
Derfor skal 11,4 gram nitrogendioxid reagere med vand for at producere 5,00 x 10²² molekyler nitrogenmonoxid.
 Varme artikler
Varme artikler
-
 En magnetisk kork til fjernelse af vandforureningKredit:Carlos III Universitetet i Madrid Universidad Carlos III de Madrid (UC3M), sammen med Universidad Pontificia de Comillas og universitetet i Porto, har patenteret en magnetisk korkprop, der
En magnetisk kork til fjernelse af vandforureningKredit:Carlos III Universitetet i Madrid Universidad Carlos III de Madrid (UC3M), sammen med Universidad Pontificia de Comillas og universitetet i Porto, har patenteret en magnetisk korkprop, der -
 Udvikling af et fast materiale, der er i stand til langsomt at frigive svovlbrinte og nitrogenoxidFast materiale, der er i stand til at frigive svovlbrinte (H 2 S) og nitrogenoxid (NO), når de udsættes for luft. Kredit:NIMS National Institute for Materials Science har udviklet et fast materi
Udvikling af et fast materiale, der er i stand til langsomt at frigive svovlbrinte og nitrogenoxidFast materiale, der er i stand til at frigive svovlbrinte (H 2 S) og nitrogenoxid (NO), når de udsættes for luft. Kredit:NIMS National Institute for Materials Science har udviklet et fast materi -
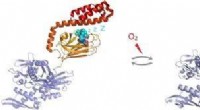 S-glutathionylering af human-inducerbar Hsp70 afslører reguleringsmekanisme, der involverer C-termi…Figur:Under oxidative stressforhold, den molekylære chaperon Hsp70 undergår post-translationel modifikation af cysteinrester ved tilsætning af tripeptidet glutathion. Glutathionylering inden for det s
S-glutathionylering af human-inducerbar Hsp70 afslører reguleringsmekanisme, der involverer C-termi…Figur:Under oxidative stressforhold, den molekylære chaperon Hsp70 undergår post-translationel modifikation af cysteinrester ved tilsætning af tripeptidet glutathion. Glutathionylering inden for det s -
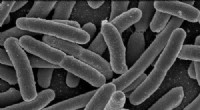 Det klareste billede nogensinde af cellemembranen giver uventet struktur, forskningsmulighederEscherichia coli. Kredit:Rocky Mountain Laboratories, NIAID, NIH Arbejde med en nobelprisvindende biofysiker, et team af forskere ved Virginia Commonwealth University har fået den klareste opfatte
Det klareste billede nogensinde af cellemembranen giver uventet struktur, forskningsmulighederEscherichia coli. Kredit:Rocky Mountain Laboratories, NIAID, NIH Arbejde med en nobelprisvindende biofysiker, et team af forskere ved Virginia Commonwealth University har fået den klareste opfatte


