Hvorfor opløses Thermocol i benzen?
Her er hvorfor:
* opløselighed er baseret på "som opløser som" princip: Dette betyder, at stoffer med lignende molekylære strukturer og intermolekylære kræfter er mere tilbøjelige til at opløses i hinanden.
* benzen er et ikke -polært opløsningsmiddel: Det har svage intermolekylære kræfter (van der Waals -styrker).
* polystyren er en ikke -polymer: Dens lange kæder er sammensat af gentagne carbonhydridenheder, der også udviser svage van der Waals -styrker.
* polystyren og benzen er kompatible: Mens de ikke rigtig opløses, kan polystyren svulme i benzen på grund af den lignende ikke -polære karakter. Benzenmolekylerne kan trænge ind i polystyrenstrukturen, hvilket får den til at ekspandere.
Det er dog vigtigt at bemærke, at:
* Denne hævelsesproces er ikke en sand opløsning. Polystyrenkæderne nedbrydes ikke og danner individuelle molekyler i benzenopløsningen.
* Det anbefales ikke At opløse polystyren i benzen på grund af de potentielle sundhedsfarer forbundet med benzen.
Kortfattet: Mens polystyren og benzen deler lignende ikke -polære egenskaber, opløses de ikke rigtig. I stedet svulmer polystyren i benzen på grund af kompatibiliteten af deres ikke -polære karakter. Det er dog vigtigt at håndtere benzen med forsigtighed på grund af dens toksicitet.
 Varme artikler
Varme artikler
-
 Video:Chemistry life hacks:MadudgaveKredit:The American Chemical Society Reactions er tilbage med endnu en omgang kemi life hacks. Vores seneste afsnit bringer kemi til køkkenet, og indeholder videnskabsstøttede tips til at tilbere
Video:Chemistry life hacks:MadudgaveKredit:The American Chemical Society Reactions er tilbage med endnu en omgang kemi life hacks. Vores seneste afsnit bringer kemi til køkkenet, og indeholder videnskabsstøttede tips til at tilbere -
 Forskere opdager serendipitalt sjælden klyngeforbindelseMetaloxidklyngerne opnået i denne undersøgelse er positivt (+) ladede i modsætning til konventionelle negativt (-) ladede. Dens overfladeprotoner er meget sure, hvilket er vigtigt i katalyse. Kredit:M
Forskere opdager serendipitalt sjælden klyngeforbindelseMetaloxidklyngerne opnået i denne undersøgelse er positivt (+) ladede i modsætning til konventionelle negativt (-) ladede. Dens overfladeprotoner er meget sure, hvilket er vigtigt i katalyse. Kredit:M -
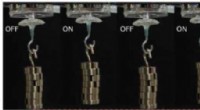 Bløde robotaktuatorer heler sig selvSerie af proteinbaserede kunstige muskler, med ydeevne, der overstiger den biologiske muskels. Andre bløde robotdele kan omfatte bløde gribere og bløde aktuatorer. Kredit:Demirel Lab, Penn State G
Bløde robotaktuatorer heler sig selvSerie af proteinbaserede kunstige muskler, med ydeevne, der overstiger den biologiske muskels. Andre bløde robotdele kan omfatte bløde gribere og bløde aktuatorer. Kredit:Demirel Lab, Penn State G -
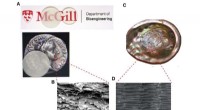 Ubrydeligt glas inspireret af muslingeskaller(A) Glaskomposit (uden indeksmatchingsstrategi til venstre og med indeksmatchning til højre), (B) Glaskomposits mikrostruktur, (C) Udsigt over det nacreøse lag i rød abalone shell, og (D) Nacres mikro
Ubrydeligt glas inspireret af muslingeskaller(A) Glaskomposit (uden indeksmatchingsstrategi til venstre og med indeksmatchning til højre), (B) Glaskomposits mikrostruktur, (C) Udsigt over det nacreøse lag i rød abalone shell, og (D) Nacres mikro
- Kinesiske astronomer undersøger spektral opførsel af gamma-ray blazar S5 0716+714
- Hurtig urbanisering i Afrika transformerer lokale fødevaresystemer og truer biodiversiteten, siger …
- Bilproducenter side med Trump i juridisk kamp med Californien
- Hvilken styrke holder universet sammen?
- Er massetal det samme som atomnummer?
- Hvordan holografisk interferometri kunne påvirke fremtiden


