Leder svovl elektricitet, når du er i vandig opløsning?
* svovl er en ikke-metal: Ikke-metaller har generelt dårlig elektrisk ledningsevne. De har ikke frie elektroner, der let kan bære en elektrisk strøm.
* svovl er ikke opløselig i vand: Svovl er i det væsentlige uopløseligt i vand. Dette betyder, at det ikke let opløses for at danne ioner, som er nødvendige for elektrisk ledningsevne i en løsning.
Imidlertid kan nogle svovlforbindelser udføre elektricitet i opløsning:
* svovlsyre (H2SO4): Når svovlsyre opløses i vand, ioniseres den i brintioner (H+) og sulfationer (SO42-). Disse ioner kan bevæge sig frit, hvilket giver løsningen til at udføre elektricitet.
* sulfider: Nogle metalsulfider, når de opløses i vand, kan danne ioner og udføre elektricitet. F.eks. Dissocieres natriumsulfid (Na2S) i natriumioner (Na+) og sulfidioner (S2-) i opløsning.
Kortfattet: Mens rent svovl ikke udfører elektricitet godt i en vandig opløsning, kan visse svovlforbindelser udføre elektricitet på grund af dannelsen af ioner i opløsning.
 Varme artikler
Varme artikler
-
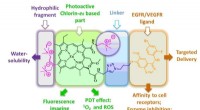 Nye meget selektive antitumor fotodynamiske terapimidler syntetiseretStrukturen af det foreslåede fotosensibilisatorkonjugat. Kredit:Lobachevsky University Et team af forskere fra Lobachevsky University (Nizhny Novgorod, Rusland) ledet af professor Alexei Fedorov
Nye meget selektive antitumor fotodynamiske terapimidler syntetiseretStrukturen af det foreslåede fotosensibilisatorkonjugat. Kredit:Lobachevsky University Et team af forskere fra Lobachevsky University (Nizhny Novgorod, Rusland) ledet af professor Alexei Fedorov -
 Bioinspirerede materialer fra mælkebøtterLuftindkapslende elastiske mekanisme af nedsænkede Taraxacum-blæsebolde. Kredit:University of Trento Marker er dækket af mælkebøtter om foråret, en meget almindelig plante med gul-guld blomster og
Bioinspirerede materialer fra mælkebøtterLuftindkapslende elastiske mekanisme af nedsænkede Taraxacum-blæsebolde. Kredit:University of Trento Marker er dækket af mælkebøtter om foråret, en meget almindelig plante med gul-guld blomster og -
 Teknikker til at observere beton, når det sætter sig, kan lette udviklingen af nye cementOlie- og naturgasboringer kræver beton for at forsegle området mellem brøndhylsteret og det omgivende borehul, men på grund af de høje temperaturer og tryk på dybden, det har været svært at studere, h
Teknikker til at observere beton, når det sætter sig, kan lette udviklingen af nye cementOlie- og naturgasboringer kræver beton for at forsegle området mellem brøndhylsteret og det omgivende borehul, men på grund af de høje temperaturer og tryk på dybden, det har været svært at studere, h -
 Hvedegluten viste sig at genoprette bindinger i skørt menneskehårKredit:Laura Tiitto/public domain Et team af forskere fra Jiangnan University i Kina og University of Nebraska i USA har fundet ud af, at integrering af hvedegluten i en shampoo hjælper med at gen
Hvedegluten viste sig at genoprette bindinger i skørt menneskehårKredit:Laura Tiitto/public domain Et team af forskere fra Jiangnan University i Kina og University of Nebraska i USA har fundet ud af, at integrering af hvedegluten i en shampoo hjælper med at gen
- Den hastighed, hvormed energi overføres, kaldes?
- Forskning beskriver langsomt og hurtigt lys i plasma
- Hvor meget varme producerer en pejs?
- De negative indvirkninger på miljøet ved at fremstille ahornsirup
- Hundens sociale færdigheder forbundet med oxytocinfølsomhed
- Kan et accelererende objekt have nul hastighed?


