Hvad er en molekylær formel?
Her er en sammenbrud:
* Kemiske symboler: Hvert element i molekylet er repræsenteret af dets unikke symbol (f.eks. H for brint, O for ilt, C for kulstof).
* Subskripter: Numre skrevet som underskrifter efter hvert element viser, hvor mange atomer af dette element der er til stede i molekylet. Hvis der ikke er skrevet nogen underskrift, antages det at være 1.
Eksempler:
* vand (H₂O): Denne formel viser, at et vandmolekyle indeholder to hydrogenatomer (H₂) og et iltatom (O).
* kuldioxid (co₂): Denne formel indikerer et carbonatom (C) og to iltatomer (O₂).
* glukose (c₆h₁₂o₆): Denne formel repræsenterer et molekyle med seks carbonatomer (C₆), tolv hydrogenatomer (H₁₂) og seks iltatomer (O₆).
Nøglepunkter:
* En molekylær formel giver kun information om typer og antal atomer i et molekyle. Det viser ikke arrangementet af atomerne eller molekylets struktur.
* Molekylære formler er vigtige for at forstå sammensætningen af stoffer og til udførelse af kemiske beregninger.
I modsætning til empiriske formler:
* Empirisk formel: Viser det enkleste forhold mellem hele nummeret for atomer i en forbindelse. For eksempel er den empiriske formel for glukose CH₂O, der repræsenterer det enkleste forhold mellem kulstof, brint og iltatomer.
* molekylær formel: Repræsenterer det faktiske antal atomer i hvert element i et molekyle.
Fortæl mig, hvis du gerne vil have flere detaljer eller eksempler!
 Varme artikler
Varme artikler
-
 Brug af neutroner til at studere, hvordan resistente bakterier udvikler sigBakterier, der indeholder enzymer kaldet beta-lactamaser, illustreret af den lyseblå klynge, nedbryde antibiotika og tillader bakterielle infektioner at udvikle sig og spredes gennem menneskelige cell
Brug af neutroner til at studere, hvordan resistente bakterier udvikler sigBakterier, der indeholder enzymer kaldet beta-lactamaser, illustreret af den lyseblå klynge, nedbryde antibiotika og tillader bakterielle infektioner at udvikle sig og spredes gennem menneskelige cell -
 Brug af aluminium og vand til at lave rent brintbrændstofLaureen Meroueh PhD ’20 (billedet) og professorerne Douglas P. Hart og Thomas W. Eagar har vist, hvordan man bruger skrotaluminium plus vand til at generere den strøm af brint, der er nødvendig til en
Brug af aluminium og vand til at lave rent brintbrændstofLaureen Meroueh PhD ’20 (billedet) og professorerne Douglas P. Hart og Thomas W. Eagar har vist, hvordan man bruger skrotaluminium plus vand til at generere den strøm af brint, der er nødvendig til en -
 Langvarig og præcis dosering af medicin takket være en olie-hydrogelblandingProfessor Job Boekhoven og Caren Wanzke ved det tekniske universitet i München opdagede et nyt materialesystem, der kan frigive lægemidler med en konstant frigivelseshastighed over en afstemmelig peri
Langvarig og præcis dosering af medicin takket være en olie-hydrogelblandingProfessor Job Boekhoven og Caren Wanzke ved det tekniske universitet i München opdagede et nyt materialesystem, der kan frigive lægemidler med en konstant frigivelseshastighed over en afstemmelig peri -
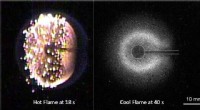 Seje flammer antændte i rummetVarme flammer (venstre) viger for kølige flammer (højre). Kredit:University of Maryland En opdagelse er blevet gjort i Jordens kredsløb - konstante sfæriske kølige diffusionsflammer. Målinger i di
Seje flammer antændte i rummetVarme flammer (venstre) viger for kølige flammer (højre). Kredit:University of Maryland En opdagelse er blevet gjort i Jordens kredsløb - konstante sfæriske kølige diffusionsflammer. Målinger i di
- Sådan bestemmes, hvor meget dine finaler påvirker din Grade
- Skolernes legepladser bliver presset:Otte måder at holde eleverne aktive i små rum
- Hvor findes genetisk materiale?
- I Global South, byens sanitetskrise skader sundheden, økonomi
- Hvad har sedimentære klipper oftere end metamorfe eller stødende klipper?
- Hvordan forholder mobiltelefoner sig til videnskab?


