Hvad består atomet til ammoniak af?
* et nitrogenatom (n): Dette atom har 7 protoner, 7 neutroner og 7 elektroner.
* tre brintatomer (H): Hvert hydrogenatom har 1 proton, 1 neutron og 1 elektron.
struktur:
Nitrogenatomet danner tre kovalente bindinger med hydrogenatomerne. Hvert hydrogenatom deler sin enkle elektron med nitrogenatomet og skaber et stabilt molekyle. Formen på ammoniakmolekylet er en trigonal pyramidal form, med nitrogenatomet ved spidsen og de tre hydrogenatomer, der danner basen.
Nøgleegenskaber:
* farveløs gas: Ammoniak er en farveløs gas ved stuetemperatur.
* stærk lugt: Det har en skarp, karakteristisk lugt.
* meget opløselig i vand: Ammoniak opløses let i vand og danner ammoniumioner (NH₄⁺) og hydroxidioner (OH⁻).
* Grundlæggende: Ammoniakopløsninger er alkaliske, hvilket betyder, at de har en pH større end 7.
* brændbar: Ammoniak er brandfarlig i luften.
anvendelser:
Ammoniak har en bred vifte af applikationer, herunder:
* Gødningsproduktion: Det er en nøgleingrediens i gødning, der leverer nitrogen til planter.
* Industrielle kemikalier: Det bruges til at fremstille forskellige kemikalier, såsom salpetersyre og urinstof.
* rengøringsmidler: Det er en komponent i mange husholdningsrengøringsprodukter.
* kølemiddel: Det bruges som kølemiddel i nogle applikationer.
Sidste artikelForekommer reaktionens natriumbromid og saltsyre?
Næste artikelHvad er nitrogen og brintforbindelse?
 Varme artikler
Varme artikler
-
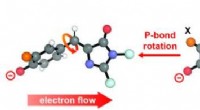 Hvordan elektriske felter påvirker et molekylært twist i lysfølsomme proteinerNår lys rammer visse kromoforer i proteiner, det får dem til at vride sig og ændre form. Denne atomare rekonfiguration, kendt som fotoisomerisering, ændrer molekylets kemiske og fysiske egenskaber. Ke
Hvordan elektriske felter påvirker et molekylært twist i lysfølsomme proteinerNår lys rammer visse kromoforer i proteiner, det får dem til at vride sig og ændre form. Denne atomare rekonfiguration, kendt som fotoisomerisering, ændrer molekylets kemiske og fysiske egenskaber. Ke -
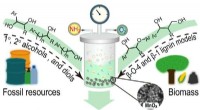 Ny strategi muliggør successiv spaltning og funktionalisering af C–C-bindinger i alkoholerSkematiske illustrationer af manganoxid til katalytisk spaltning og funktionalisering af alkoholreaktion. Kredit:He Peipei Et forskerhold ledet af prof. Dai Wen fra Dalian Institute of Chemical Phy
Ny strategi muliggør successiv spaltning og funktionalisering af C–C-bindinger i alkoholerSkematiske illustrationer af manganoxid til katalytisk spaltning og funktionalisering af alkoholreaktion. Kredit:He Peipei Et forskerhold ledet af prof. Dai Wen fra Dalian Institute of Chemical Phy -
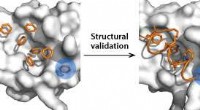 Benzen-baserede prober fremhæver to skjulte bindingssteder på et anticancer-lægemiddelmålBindingslommedetektion ved hjælp af benzenmolekyler som prober (venstre) og strukturel validering ved brug af hæftede peptider (højre). Kredit:Y. S. Tan et al. I jagten på nye kræftbehandlinger, A
Benzen-baserede prober fremhæver to skjulte bindingssteder på et anticancer-lægemiddelmålBindingslommedetektion ved hjælp af benzenmolekyler som prober (venstre) og strukturel validering ved brug af hæftede peptider (højre). Kredit:Y. S. Tan et al. I jagten på nye kræftbehandlinger, A -
 Fremstilling af snoede halvledere til 3D-projektionEn smartphone-skærm, der kan producere 3D-billeder, skal kunne vride lyset, den udsender. Nu, forskere ved University of Michigan og Ben-Gurion University i Negev har opdaget en måde at masseproducere
Fremstilling af snoede halvledere til 3D-projektionEn smartphone-skærm, der kan producere 3D-billeder, skal kunne vride lyset, den udsender. Nu, forskere ved University of Michigan og Ben-Gurion University i Negev har opdaget en måde at masseproducere
- Hvilket biologisk molekyle indeholder en stor mængde af elementets nitrogen?
- Hvordan adskiller cirkulerende hormoner sig fra parakriner og autokriner med hensyn til deres målce…
- Vinregioner kan skrumpe dramatisk med klimaændringer, medmindre producenterne bytter sorter
- Lab-to-market undersøgelse udforsker succes
- Tests sikrer astronaut, jordbesætningssikkerhed inden Orion lanceres
- Hvad er egenskaberne ved opløsning i sukker?


