Hvad er en gruppe af forbindelser, der frigiver ioner, når de blev opløst i vand, der kaldes?
Her er hvorfor:
* elektrolytter er stoffer, der udfører elektricitet, når de opløses i vand. Denne ledningsevne skyldes tilstedeværelsen af frie ioner, der er ladede partikler, der kan bevæge sig frit.
* Når en elektrolyt opløses i vand, bryder den ned i dens bestanddele. For eksempel opløses tabelsalt (NaCl) i vand til dannelse af natriumioner (Na+) og chloridioner (Cl-).
* Tilstedeværelsen af disse frie ioner gør det muligt for løsningen at udføre elektricitet.
Eksempler på elektrolytter:
* Salt (som natriumchlorid, kaliumchlorid)
* Syrer (som saltsyre, svovlsyre)
* Baser (som natriumhydroxid, kaliumhydroxid)
Vigtig note: Ikke alle forbindelser er elektrolytter. Nogle forbindelser, som sukker (saccharose), adskiller sig ikke i ioner, når de opløses i vand og kaldes derfor ikke -elektrolytter .
Sidste artikelHvad er den afgivne gas, når fortyndet saltsyre reagerer med natriumcarbonat?
Næste artikelHvad laver tin og klor?
 Varme artikler
Varme artikler
-
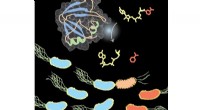 Ny indsigt i plantemikrobiomets molekylære våbenBilledet viser Tne2, et NAD-nedbrydende enzym udskilt gennem type 6 sekretionssystem af den plantebeskyttende bakterie Pseudomonas protegens. Kredit:John Whitney, McMaster University Som alle orga
Ny indsigt i plantemikrobiomets molekylære våbenBilledet viser Tne2, et NAD-nedbrydende enzym udskilt gennem type 6 sekretionssystem af den plantebeskyttende bakterie Pseudomonas protegens. Kredit:John Whitney, McMaster University Som alle orga -
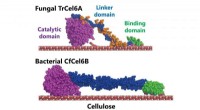 Bakteriel cellulosenedbrydningssystem kunne sætte skub i produktionen af biobrændstofferStrukturelle modeller af svampe- og bakteriecellobiohydrolaser (TrCel6A, CfCel6B) Kredit:NINS/IMS Bestræbelser på at finde måder at nedbryde cellulose - de hårde ting, der udgør plantecellevægge -
Bakteriel cellulosenedbrydningssystem kunne sætte skub i produktionen af biobrændstofferStrukturelle modeller af svampe- og bakteriecellobiohydrolaser (TrCel6A, CfCel6B) Kredit:NINS/IMS Bestræbelser på at finde måder at nedbryde cellulose - de hårde ting, der udgør plantecellevægge - -
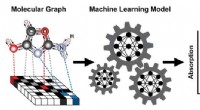 Forudsigelse af røntgenabsorptionsspektre fra graferEt skema, der viser trinene til træning af en maskinlæringsmodel til at forudsige et røntgenabsorptionsspektrum (XAS) baseret på den kendte struktur af et molekyle. Molekylets struktur er repræsentere
Forudsigelse af røntgenabsorptionsspektre fra graferEt skema, der viser trinene til træning af en maskinlæringsmodel til at forudsige et røntgenabsorptionsspektrum (XAS) baseret på den kendte struktur af et molekyle. Molekylets struktur er repræsentere -
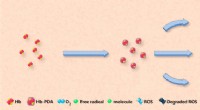 Fremstilling af kunstigt blod til transfusionerKredit:American Chemical Society Blodtransfusioner kan redde livet for patienter, der har lidt stort blodtab, men hospitaler har ikke altid nok eller den rigtige type ved hånden. På jagt efter en
Fremstilling af kunstigt blod til transfusionerKredit:American Chemical Society Blodtransfusioner kan redde livet for patienter, der har lidt stort blodtab, men hospitaler har ikke altid nok eller den rigtige type ved hånden. På jagt efter en
- Blandt indiske arbejdere fattige, ædruelighed kan øge besparelserne
- Har du en intern dialog? Ikke alle gør
- Er solen over skyer eller under skyer?
- Bliver syrer lakmuspapir rødt?
- Selvjusterende mikroskop smadrer grænserne for superopløsningsmikroskopi
- Hvilken horisont er materialer, der udvaskes fra A, aflejret i denne horisont?


