Metaller, der er mindre reaktive end alkalimetaller og alkalisk jord kaldes?
Her er hvorfor:
* reaktivitet: Alkalimetaller (gruppe 1) og alkaliske jordmetaller (gruppe 2) er de mest reaktive metaller. Dette skyldes deres relativt lave ioniseringsenergier og deres tendens til at miste henholdsvis en eller to elektroner til dannelse af positive ioner.
* Overgangsmetaller: Overgangsmetaller besætter den centrale blok i den periodiske tabel. De er mindre reaktive end alkali- og alkalisk-jord-metaller, fordi de har en mere kompleks elektronkonfiguration med elektroner i både D- og S-orbitaler. Dette fører til stærkere metallisk binding og en lavere tendens til at miste elektroner.
Eksempler på overgangsmetaller:
* Jern (Fe)
* Kobber (CU)
* Guld (AU)
* Nikkel (NI)
* Platinum (PT)
Mens overgangsmetaller generelt er mindre reaktive end alkali- og alkalisk-jord-metaller, er der undtagelser. For eksempel kan nogle overgangsmetaller som mangan (MN) være ret reaktive.
 Varme artikler
Varme artikler
-
 Kemikere opdager uventet enzymstrukturMIT-forskere har vist, at nogle af atomerne i et enzym kaldet carbonmonoxiddehydrogenase kan omarrangere sig selv, når iltniveauet er lavt. Et nikkelatom (grønt) forlader den terninglignende struktur,
Kemikere opdager uventet enzymstrukturMIT-forskere har vist, at nogle af atomerne i et enzym kaldet carbonmonoxiddehydrogenase kan omarrangere sig selv, når iltniveauet er lavt. Et nikkelatom (grønt) forlader den terninglignende struktur, -
 Udvinding af dyrebare sjældne jordarters grundstoffer fra kulflyveaske med en genanvendelig ionisk …Kredit:Grant Wilson/public domain Sjældne jordarters elementer er i mange hverdagsprodukter, såsom smartphones, LED lys og batterier. Imidlertid, kun nogle få steder har store forekomster, der er
Udvinding af dyrebare sjældne jordarters grundstoffer fra kulflyveaske med en genanvendelig ionisk …Kredit:Grant Wilson/public domain Sjældne jordarters elementer er i mange hverdagsprodukter, såsom smartphones, LED lys og batterier. Imidlertid, kun nogle få steder har store forekomster, der er -
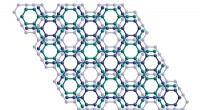 Langhypoteseret næste generations vidundermateriale skabt for første gangKrystalstrukturen af et lag af grafyn. Kredit:Yiming Hu I over et årti har forskere forsøgt at syntetisere en ny form for kulstof kaldet grafyn med begrænset succes. Den bestræbelse er dog nu ved
Langhypoteseret næste generations vidundermateriale skabt for første gangKrystalstrukturen af et lag af grafyn. Kredit:Yiming Hu I over et årti har forskere forsøgt at syntetisere en ny form for kulstof kaldet grafyn med begrænset succes. Den bestræbelse er dog nu ved -
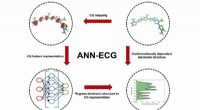 Ny tilgang til molekylær modellering kan fremskynde udviklingen af nye organiske materialer til e…Skematisk af ANN-EKG-metoden anvendt i dette arbejde. Skematisk eksempel viser en tre-perle/monomer grovkornet molekylær modelkortlægning for sexi (3-methyl) thiophen. Kredit:Argonne National Laborato
Ny tilgang til molekylær modellering kan fremskynde udviklingen af nye organiske materialer til e…Skematisk af ANN-EKG-metoden anvendt i dette arbejde. Skematisk eksempel viser en tre-perle/monomer grovkornet molekylær modelkortlægning for sexi (3-methyl) thiophen. Kredit:Argonne National Laborato
- Sundhedspersonale er vigtige formidlere til at håndtere klimaændringer
- Paul bruger en 400Newton -styrke til at skubbe til et objekt 8 meter Pauline 300Newton 10 Hvem gjord…
- Undersøgelse giver en bedre forståelse af, hvordan husholdning foregår i celler
- Hvor længe varer kalksten i?
- Kunne 'Oumuamua være et udenjordisk solsejl?
- Hvad opfandt Albert Einstein?


