Angiv den vigtigste type opløst-sovende interaktion og rangopløsninger fra svageste til stærkeste KCl i vand CH2Cl2 benzen C6H6 CH3OH H2O?
Solute-opløsningsmiddelinteraktioner:
* KCL i vand (H₂O): ion-dipol-interaktion. KCl er en ionisk forbindelse, der opløses i k⁺- og Cl⁻ioner. Vand er et polært molekyle med en delvis positiv ladning på brintatomerne og en delvis negativ ladning på iltatomet. De positive ioner (k⁺) tiltrækkes af den negative ende af vandmolekyler, og de negative ioner (cl⁻) tiltrækkes af den positive ende af vandmolekyler.
* ch₂cl₂ (dichlormethan) i benzen (c₆h₆): London Dispersion Forces. Både dichlormethan og benzen er ikke -polære molekyler. Den eneste interaktion mellem dem er svage London -spredningskræfter, der opstår som følge af midlertidige udsving i elektronfordeling.
* ch₃oh (methanol) i vand (H₂O): Hydrogenbinding. Methanol er et polært molekyle med et hydrogenatom bundet til ilt. Vand har også hydrogenbinding. Brintbindingen mellem methanol og vand er stærkere end London-spredningskræfter, men svagere end ion-dipol-interaktioner.
* c₆h₆ (benzen) i c₆h₆ (benzen): London Dispersion Forces. Benzen er et ikke -polært molekyle. Den eneste interaktion mellem benzenmolekyler er svage London -spredningskræfter.
* h₂o (vand) i H₂O (vand): Hydrogenbinding. Vandmolekyler danner stærke brintbindinger med hinanden.
Rangering fra svageste til stærkest:
1. Svagest.
2. ch₂cl₂ i C₆H₆ (London Dispersion Forces): Lidt stærkere end benzen-benzen på grund af større størrelse.
3. ch₃oh i H₂O (hydrogenbinding): Stærkere på grund af hydrogenbinding.
4. KCL i H₂O (ion-dipol-interaktion): Stærkest på grund af stærke elektrostatiske attraktioner.
Vigtig note: Styrken af intermolekylære kræfter påvirkes også af størrelsen og formen af molekylerne. For eksempel har større molekyler en tendens til at have stærkere London -spredningskræfter.
 Varme artikler
Varme artikler
-
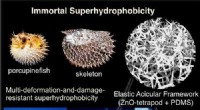 Porcupinefish inspirerer robust superhydrofobt materialeKredit:American Chemical Society Naturen har udviklet et blændende udvalg af materialer, der hjælper organismer med at trives i forskellige levesteder. Sommetider, videnskabsmænd kan udnytte disse
Porcupinefish inspirerer robust superhydrofobt materialeKredit:American Chemical Society Naturen har udviklet et blændende udvalg af materialer, der hjælper organismer med at trives i forskellige levesteder. Sommetider, videnskabsmænd kan udnytte disse -
 Planter kan modstå klimaforandringer og komme sig efter tørke ved at justere lignin-kemiske kodePlanterørscelle forstærket med lignin er meget modstandsdygtig over for undertryk i modsætning til de andre fladtrykte celler omkring. Kredit:Cheng Choo Lee En ny undersøgelse viser, at vi kan skab
Planter kan modstå klimaforandringer og komme sig efter tørke ved at justere lignin-kemiske kodePlanterørscelle forstærket med lignin er meget modstandsdygtig over for undertryk i modsætning til de andre fladtrykte celler omkring. Kredit:Cheng Choo Lee En ny undersøgelse viser, at vi kan skab -
 Fødevareingrediensblandinger mere følsomme over for klimaændringer, undersøgelse finderMauers laboratorieforskning afslører, at fugtsorption i fødevareblandinger er mere følsomme over for klimaændringer end enkelte ingredienser. Kredit:Purdue Department of Food Science foto En nylig
Fødevareingrediensblandinger mere følsomme over for klimaændringer, undersøgelse finderMauers laboratorieforskning afslører, at fugtsorption i fødevareblandinger er mere følsomme over for klimaændringer end enkelte ingredienser. Kredit:Purdue Department of Food Science foto En nylig -
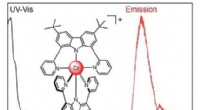 Et nyt kromkompleks udsender lys i uhåndgribelig NIR-II-bølgelængdeKredit:Wiley Mange applikationer, fra fiberoptisk telekommunikation til biomedicinske billeddannelsesprocesser kræver stoffer, der udsender lys i det nær-infrarøde område (NIR). Et forskerhold i S
Et nyt kromkompleks udsender lys i uhåndgribelig NIR-II-bølgelængdeKredit:Wiley Mange applikationer, fra fiberoptisk telekommunikation til biomedicinske billeddannelsesprocesser kræver stoffer, der udsender lys i det nær-infrarøde område (NIR). Et forskerhold i S


