Hvilken energi er nødvendig for at starte en kemisk reaktion?
Her er en sammenbrud:
* Aktiveringsenergi: Den mindste mængde energi, som de reagerende molekyler skal have for at gennemgå en kemisk reaktion.
* hvordan det fungerer: Molekyler har brug for en bestemt mængde energi for at bryde eksisterende bindinger og danne nye. Aktiveringsenergi giver denne indledende energi "skub" for at få reaktionen i gang.
* Analogi: Tænk på en bold, der sidder øverst på en bakke. Det har potentiel energi, men ruller ikke ned, medmindre det får et lille skub (aktiveringsenergi).
Faktorer, der påvirker aktiveringsenergi:
* Natur af reaktanter: Nogle molekyler har stærkere bindinger end andre, hvilket kræver mere energi til at bryde.
* Temperatur: Højere temperaturer betyder, at molekyler har mere kinetisk energi, hvilket øger sandsynligheden for at nå aktiveringsenergitærsklen.
* katalysator: En katalysator fremskynder en reaktion ved at sænke aktiveringsenergien, hvilket gør det lettere for molekyler at reagere.
Betydningen af aktiveringsenergi:
* Kontrol af reaktioner: Forståelse af aktiveringsenergi hjælper os med at kontrollere kemiske reaktioner, såsom i industrielle processer eller biologiske systemer.
* Stabilitet af molekyler: Aktiveringsenergi hjælper med at forklare, hvorfor nogle molekyler er mere stabile end andre. Molekyler med høje aktiveringsenergier kræver en masse energi for at reagere, hvilket gør dem mindre tilbøjelige til at nedbrydes.
Fortæl mig, hvis du har andre spørgsmål om kemiske reaktioner eller aktiveringsenergi!
Sidste artikelHvad er fakta om brint?
Næste artikelHvad er densiteten af brintgas?
 Varme artikler
Varme artikler
-
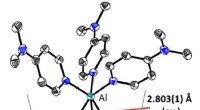 Vigtig milepæl på vejen mod overgangsmetalkatalyse med aluminiumKredit:Albert-Ludwigs-Universität Freiburg im Breisgau Kemikerne Philipp Dabringhaus, Julie Willrett og Prof. Dr. Ingo Krossing fra Institut for Uorganisk og Analytisk Kemi ved Universitetet i Frei
Vigtig milepæl på vejen mod overgangsmetalkatalyse med aluminiumKredit:Albert-Ludwigs-Universität Freiburg im Breisgau Kemikerne Philipp Dabringhaus, Julie Willrett og Prof. Dr. Ingo Krossing fra Institut for Uorganisk og Analytisk Kemi ved Universitetet i Frei -
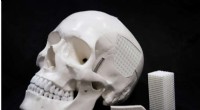 Æggeskalsbaseret kirurgisk materiale til kranieskaderSkalleimplantat. Kredit:NUST MISIS En bioaktiv polymer-keramisk komposit til fiksering af implantater og gendannelse af knogledefekter i kraniet er udviklet af en international gruppe af materiale
Æggeskalsbaseret kirurgisk materiale til kranieskaderSkalleimplantat. Kredit:NUST MISIS En bioaktiv polymer-keramisk komposit til fiksering af implantater og gendannelse af knogledefekter i kraniet er udviklet af en international gruppe af materiale -
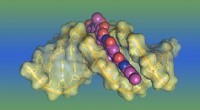 Dechifrering af hemmeligheder af potente DNA-toksinerMolekylær model af den læsion, som det bakterielle toksin yatakemycin danner på DNA. Kredit:Elwood Mullins / Vanderbilt Et af de mest potente toksiner, der er kendt, virker ved at svejse de to str
Dechifrering af hemmeligheder af potente DNA-toksinerMolekylær model af den læsion, som det bakterielle toksin yatakemycin danner på DNA. Kredit:Elwood Mullins / Vanderbilt Et af de mest potente toksiner, der er kendt, virker ved at svejse de to str -
 Forvandling af kuldioxid til værdifulde produkterProfessor Ariel Furst (i midten), bachelorstuderende Rachel Ahlmark (til venstre), postdoc Gang Fan (til højre) og deres kolleger anvender biologiske materialer, herunder DNA, for at opnå omdannelsen
Forvandling af kuldioxid til værdifulde produkterProfessor Ariel Furst (i midten), bachelorstuderende Rachel Ahlmark (til venstre), postdoc Gang Fan (til højre) og deres kolleger anvender biologiske materialer, herunder DNA, for at opnå omdannelsen
- Hvordan kan jeg bruge en teleskop -projektor til at forbedre min stargazing -oplevelse?
- Forskere opdager et system med tre planeter på størrelse med Jorden
- Model viser, hvordan fisk synkroniserer halefinner for at spare energi
- Hvorfor ser det ud til, at solen stiger, og det er faktisk ikke bevæger sig?
- Hvorfor bruges sølv- og guldmetaller?
- Sentinelsatellitter afslører øst -vest skift i italiensk jordskælv


