Hvad er de forskellige ved valenselektroner for alle elementer i en gruppe?
Her er hvorfor:
* Valenselektroner: Dette er elektronerne i det yderste energiniveau af et atom. Det er dem, der er involveret i kemisk binding.
* grupper og elektronkonfiguration: Elementer i den samme gruppe har det samme antal valenselektroner, fordi de har den samme ydre elektronkonfiguration. Dette betyder, at de har det samme antal elektroner i deres yderste energiniveau.
Eksempel:
* gruppe 1 (alkalimetaller): Lithium (Li), natrium (NA), kalium (K), Rubidium (RB), Cesium (CS) og Francium (FR) har alle 1 valenselektron.
* gruppe 17 (halogener): Fluor (F), chlor (CL), brom (BR), jod (I) og astatine (AT) har alle 7 valenselektroner.
Betydning:
Antallet af valenselektroner bestemmer et elements kemiske egenskaber, herunder:
* reaktivitet: Elementer med en næsten fuld eller tom ydre skal er mere reaktive.
* binding: Antallet af valenselektroner dikterer de typer bindinger, et element kan danne.
Key Takeaway: Elementer i den samme gruppe på det periodiske tabel deler det samme antal valenselektroner, hvilket bidrager til deres lignende kemiske opførsel.
 Varme artikler
Varme artikler
-
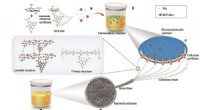 Forskere bruger mikroorganismer til at fremstille funktionel bakteriel cellulose in situGlucose (Glc) blev modificeret med 6CF, og 6CF-Glc blev brugt som en kulstofkilde til K. sucrofermentans fermentering for at opnå 6CF-BC gennem mikrobielle metaboliske veje Kredit:GAO Minghong Bak
Forskere bruger mikroorganismer til at fremstille funktionel bakteriel cellulose in situGlucose (Glc) blev modificeret med 6CF, og 6CF-Glc blev brugt som en kulstofkilde til K. sucrofermentans fermentering for at opnå 6CF-BC gennem mikrobielle metaboliske veje Kredit:GAO Minghong Bak -
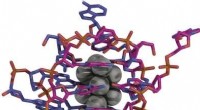 Bestemmelse af krystalstrukturen af en DNA-stabiliseret sølv nanoclusterKredit:Angewandte Chemie Nanoclusters er små dynger af nogle få atomer, der ofte har interessante optiske egenskaber og kan blive nyttige prober til billeddannelsesprocesser inden for områder som
Bestemmelse af krystalstrukturen af en DNA-stabiliseret sølv nanoclusterKredit:Angewandte Chemie Nanoclusters er små dynger af nogle få atomer, der ofte har interessante optiske egenskaber og kan blive nyttige prober til billeddannelsesprocesser inden for områder som -
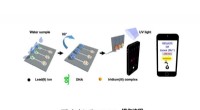 Ny enhed til hurtig og præcis detektering af blyDiagrammet viser detektionsprocessen. Kredit:HKBU Et forskerhold fra Institut for Kemi ved Hong Kong Baptist University (HKBU) har opfundet en bærbar enhed til one-stop-detektion af blykoncentrati
Ny enhed til hurtig og præcis detektering af blyDiagrammet viser detektionsprocessen. Kredit:HKBU Et forskerhold fra Institut for Kemi ved Hong Kong Baptist University (HKBU) har opfundet en bærbar enhed til one-stop-detektion af blykoncentrati -
 Billeder af usynlige huller på celler kan sætte gang i forskningenSeks mikroskopiske billeder af 3D-poreproteinet pannexin 1. Billederne blev optaget ved hjælp af kryo-elektronmikroskopi. Hvert poreprotein er omkring 6 nm bredt. Det betyder, at godt 300, 000 kunne p
Billeder af usynlige huller på celler kan sætte gang i forskningenSeks mikroskopiske billeder af 3D-poreproteinet pannexin 1. Billederne blev optaget ved hjælp af kryo-elektronmikroskopi. Hvert poreprotein er omkring 6 nm bredt. Det betyder, at godt 300, 000 kunne p
- Hvad er beskrivelsen af brint?
- Talende handsker, taktile vinduer:Ny teknologi hjælper handicappede
- Hvilken by har disse koordinater 1s og 37e?
- Hvad betyder røde stjerner på himlen?
- Teknikken tillader praktisk, præcis optisk billeddannelse af individuelle proteiner
- Hvordan hørte folk om månelanding fra 1969?


