Hvad er handlingen af H2O2 på KMNO4?
samlet reaktion:
Under sure forhold er reaktionen en redoxreaktion, hvor permanganationer (MnO₄⁻) reduceres til mangan (II) -ioner (Mn²⁺) og hydrogenperoxid oxideres til iltgas (O₂).
Forenklet ligning:
2 kmno₄ + 3H₂O₂ + 3H₂SO₄ → K₂so₄ + 2mnso₄ + 8h₂o + 3o₂
Forklaring:
* reduktion af permanganat: Permanganationen (MNO₄⁻) fungerer som et oxidationsmiddel, får elektroner og reduceres til Mn²⁺.
* Oxidation af hydrogenperoxid: Hydrogenperoxid (H₂O₂) fungerer som et reducerende middel, mister elektroner og bliver oxideret til O₂.
* sure forhold: Reaktionen har brug for et surt miljø, normalt tilvejebragt af svovlsyre (H₂so₄), til reduktion af permanganatet for at fortsætte.
Vigtige noter:
* reaktionshastighed: Reaktionshastigheden er påvirket af faktorer som temperatur, koncentration af reaktanter og tilstedeværelsen af katalysatorer.
* bivirkninger: I nogle tilfælde kan andre manganarter, såsom MNO₂ (mangandioxid), dannes som sideprodukter.
* Sikkerhedshensyn: Denne reaktion er eksoterm og kan være kraftig. Der skal udvises omhu, når man håndterer disse kemikalier.
Ansøgninger:
Denne reaktion har flere applikationer, herunder:
* Analytisk kemi: Bruges til titrering af hydrogenperoxid til at bestemme dets koncentration.
* Organisk kemi: Bruges som oxidationsmiddel i forskellige organiske reaktioner.
* Miljøkemi: Bruges til afhjælpning af forurenet vand.
Sammenfattende er reaktionen mellem H₂O₂ og KMNO₄ en kompleks redoxproces, hvor permanganatet reduceres og hydrogenperoxid oxideres, hvilket genererer mangan (II) ioner, iltgas og andre produkter afhængigt af forholdene.
Sidste artikelEr vandig ammoniak en elementforbindelse eller blanding?
Næste artikelHvad er forbindelsen af PBL4?
 Varme artikler
Varme artikler
-
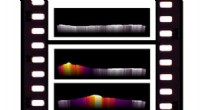 Visualisering af kemiske reaktioner med infrarød termografiTermisk billedsekvens, der viser den eksoterme overfladereaktionsfront, der bevæger sig over katalysatoren. Kredit:ACS Catalysis; DOI:10.1021/acscatal.9b04475 Infrarød (IR) termografi bruges til a
Visualisering af kemiske reaktioner med infrarød termografiTermisk billedsekvens, der viser den eksoterme overfladereaktionsfront, der bevæger sig over katalysatoren. Kredit:ACS Catalysis; DOI:10.1021/acscatal.9b04475 Infrarød (IR) termografi bruges til a -
 Trykpåvirkning er ikke skyld i tilsmudsning af membraner, undersøgelse finderEmily Tow PhD 17, viser udstyr, hun har udviklet til at måle virkningerne af forskellige trykniveauer på den måde, mikroorganismer opbygges på membraner, der bruges til afsaltning af vand. Kredit:Mass
Trykpåvirkning er ikke skyld i tilsmudsning af membraner, undersøgelse finderEmily Tow PhD 17, viser udstyr, hun har udviklet til at måle virkningerne af forskellige trykniveauer på den måde, mikroorganismer opbygges på membraner, der bruges til afsaltning af vand. Kredit:Mass -
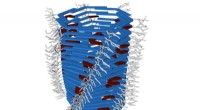 Forskere udvikler en ny type syntetisk molekylær maskineTubuline. Kredit:University of Twente Forskere ved University of Twentes forskningsinstitut MESA+ konstruerer molekylære maskiner, der er i stand til at udøve en målbar kraft på nanoskala og i fly
Forskere udvikler en ny type syntetisk molekylær maskineTubuline. Kredit:University of Twente Forskere ved University of Twentes forskningsinstitut MESA+ konstruerer molekylære maskiner, der er i stand til at udøve en målbar kraft på nanoskala og i fly -
 Krystalstruktur opdaget for næsten 200 år siden kunne indeholde nøglen til solcellens revolutionPerovskite struktur. Kredit:John Labram, Oregon State University. Solenergiforskere ved Oregon State University skinner deres videnskabelige fokus på materialer med en krystalstruktur opdaget for
Krystalstruktur opdaget for næsten 200 år siden kunne indeholde nøglen til solcellens revolutionPerovskite struktur. Kredit:John Labram, Oregon State University. Solenergiforskere ved Oregon State University skinner deres videnskabelige fokus på materialer med en krystalstruktur opdaget for
- Hvordan agroøkologi kan være en del af en 'retfærdig overgang' for Canadas fødevaresystem
- Hvordan blev udbruddet på Montserrat styret?
- Hvordan du kan hjælpe med at beskytte hajer, og hvad virker ikke
- Hvilket ord henviser til formen af en bakterie?
- Hvad betyder det med universet og
- Et stjernesystem, hvor lyset fra et andet kaldes?


