Hvorfor opløses siliciumdioxid ikke i vand?
1. Stærke Si-O-obligationer: Bindingerne mellem silicium og ilt i SiO2 er utroligt stærke, hvilket kræver en betydelig mængde energi at bryde. Vandmolekyler, med deres relativt svage brintbindinger, har simpelthen ikke nok energi til at forstyrre disse stærke bindinger.
2. Polarity Mismatch: Vand er et polært molekyle, hvilket betyder, at det har en positiv og negativ ende. SiO2 er på den anden side et meget ikke-polært molekyle. Manglen på polaritet mellem vand og SiO2 forhindrer dem i at danne gunstige interaktioner og opløsning.
3. Dannelse af en stabil gitterstruktur: Siliciumdioxid danner en stiv, tredimensionel netværksstruktur med stærke kovalente bindinger. Denne struktur er ekstremt stabil og modstår forstyrrelse af vandmolekyler.
4. Produkt med lav opløselighed: Opløselighedsproduktet af SiO2 i vand er ekstremt lavt, hvilket betyder, at kun en lille mængde SiO2 kan opløses under standardbetingelser.
5. Dannelsen af et hydreret lag: Selvom SiO2 ikke opløses, kan det danne et tyndt lag hydreret silica på dens overflade, når den udsættes for vand. Dette lag fungerer som en barriere, hvilket yderligere forhindrer bulkopløsningen af det faste stof.
Undtagelser:
Mens SiO2 generelt betragtes som uopløselig i vand, er der nogle få undtagelser:
* Høj pH: Under stærkt alkaliske tilstande (høj pH) kan SiO2 opløses i større grad og danne opløselige silikationer. Dette er grunden til, at nogle typer glas kan ætses af stærke baser.
* hydrofluorinsyre: SiO2 reagerer med hydrofluorinsyre (HF) for at danne siliciumtetrafluorid (SIF4), som er en gas. Denne reaktion bruges til at ætse glas.
Kortfattet: Siliciumdioxides stærke bindinger, mangel på polaritet, stabil gitterstruktur, produkt med lav opløselighed og dannelsen af et hydreret lag bidrager alle til dets uopløselighed i vand.
Sidste artikelEr natriumhydroxid en baser eller syrer?
Næste artikelHvad er den binære kovalente sammensatte phosphor -pentabromid?
 Varme artikler
Varme artikler
-
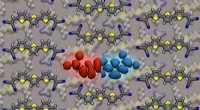 Tuning the energy gap:En ny tilgang til organiske halvledereVarierende forholdet mellem 3T -molekyler (forgrund) og 6T -molekyler (angivet i baggrunden) i blandingen gør det muligt at afstemme hullet kontinuerligt. Kredit:Sebastian Hutsch, Frank Ortmann Tu
Tuning the energy gap:En ny tilgang til organiske halvledereVarierende forholdet mellem 3T -molekyler (forgrund) og 6T -molekyler (angivet i baggrunden) i blandingen gør det muligt at afstemme hullet kontinuerligt. Kredit:Sebastian Hutsch, Frank Ortmann Tu -
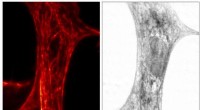 Kombineret røntgen- og fluorescensmikroskop afslører usete molekylære detaljerSTED-billede (venstre) og røntgenbillede (højre) af den samme hjertevævscelle fra en rotte. For STED, netværket af actin filamenter i cellen, hvilket er vigtigt for cellens mekaniske egenskaber, er bl
Kombineret røntgen- og fluorescensmikroskop afslører usete molekylære detaljerSTED-billede (venstre) og røntgenbillede (højre) af den samme hjertevævscelle fra en rotte. For STED, netværket af actin filamenter i cellen, hvilket er vigtigt for cellens mekaniske egenskaber, er bl -
 Fjernelse af kuldioxid fra kraftværkets udstødningMIT assisterende professor Betar Gallant (til venstre) og kandidatstuderende Aliza Khurram er ved at udvikle et nyt batteri, der både kan fange kuldioxid i kraftværkets udstødning og omdanne det til e
Fjernelse af kuldioxid fra kraftværkets udstødningMIT assisterende professor Betar Gallant (til venstre) og kandidatstuderende Aliza Khurram er ved at udvikle et nyt batteri, der både kan fange kuldioxid i kraftværkets udstødning og omdanne det til e -
 Hvorfor barbering gør selv de skarpeste barbermaskiner sløveKredit:Unsplash/CC0 Public Domain Barbermaskiner, skalpeller, og knive er normalt fremstillet af rustfrit stål, slebet til en knivskarp kant og belagt med endnu hårdere materialer såsom diamantlig
Hvorfor barbering gør selv de skarpeste barbermaskiner sløveKredit:Unsplash/CC0 Public Domain Barbermaskiner, skalpeller, og knive er normalt fremstillet af rustfrit stål, slebet til en knivskarp kant og belagt med endnu hårdere materialer såsom diamantlig
- NASA rumcopter klar til første Mars-flyvning
- Udvikling af DNA-fælde baner vej for personlig medicin
- Hvad er en ekspereimentel gruppe inden for videnskab?
- Effekten af rumstationsspin kræver undersøgelse, siger embedsmand
- Hvordan fysik bryder sammen i et sort hul
- Forskere finder bevis for 68 evige kemikalier i fødevareemballage rundt om i verden


