Fjernelse af kuldioxid fra kraftværkets udstødning

MIT assisterende professor Betar Gallant (til venstre) og kandidatstuderende Aliza Khurram er ved at udvikle et nyt batteri, der både kan fange kuldioxid i kraftværkets udstødning og omdanne det til et fast stof, der er klar til sikker bortskaffelse. Kredit:Stuart Darsch
Reduktion af kuldioxid (CO 2 ) emissioner fra kraftværker betragtes bredt som en væsentlig komponent i enhver plan for afbødning af klimaændringer. Mange forskningsindsatser fokuserer på at udvikle og implementere CO2-opsamlings- og -sekvestreringssystemer (CCS) for at holde CO 2 emissioner fra kraftværker ud af atmosfæren. Men at adskille den fangede CO 2 og at konvertere den tilbage til en gas, der kan lagres, kan forbruge op til 25 procent af et anlægs elproduktionskapacitet. Ud over, CO 2 gas sprøjtes generelt ind i underjordiske geologiske formationer til langtidsopbevaring - en bortskaffelsesmetode, hvis sikkerhed og pålidelighed forbliver ubevist.
En bedre tilgang ville være at omdanne den opfangede CO 2 til nyttige produkter såsom værditilvækst brændstof eller kemikalier. Til det formål, opmærksomheden har fokuseret på elektrokemiske processer - i dette tilfælde, en proces, hvor kemiske reaktioner frigiver elektrisk energi, som ved afladning af et batteri. Det ideelle medium til at udføre elektrokemisk omdannelse af CO 2 ser ud til at være vand. Vand kan give de protoner (positivt ladede partikler), der er nødvendige for at lave brændstoffer såsom metan. Men at drive sådanne "vandige" (vandbaserede) systemer kræver store energiinput, og kun en lille del af de dannede produkter er typisk dem af interesse.
Betar Gallant, en adjunkt i maskinteknik, og hendes gruppe på MIT har derfor fokuseret på ikke-vandige (vandfrie) elektrokemiske reaktioner – især, dem, der forekommer inde i lithium-CO 2 batterier.
Forskning i lithium-CO 2 batterier er i sine meget tidlige stadier, ifølge Gallant, men interessen for dem vokser, fordi CO 2 bruges i de kemiske reaktioner, der sker på en af elektroderne, når batteriet aflades. Imidlertid, CO 2 er ikke særlig reaktiv. Forskere har forsøgt at fremskynde tingene ved at bruge forskellige elektrolytter og elektrodematerialer. På trods af sådanne bestræbelser, behovet for at bruge dyre metalkatalysatorer til at fremkalde elektrokemisk aktivitet har bestået.
På grund af de manglende fremskridt, Gallant ville prøve noget andet. "Vi var interesserede i at prøve at bringe en ny kemi til at påvirke problemet, " siger hun. Og henter hjælp fra de sorberende molekyler, der så effektivt fanger CO 2 i CCS virkede som en lovende vej at gå.
At genoverveje amin
Det sorberende molekyle, der anvendes i CCS, er en amin, et derivat af ammoniak. I CCS, udstødningen bobles gennem en aminholdig opløsning, og aminen binder kemisk CO 2 , fjerne det fra udstødningsgasserne. CO 2 -nu i flydende form - skilles derefter fra aminen og omdannes tilbage til en gas til bortskaffelse.

Kandidatstuderende Aliza Khurram forbereder sig til eksperimenter ved at pumpe kuldioxid gennem en elektrokemisk celle bestående af lithium- og kulelektroder plus en specialdesignet elektrolyt. Kredit:Stuart Darsch
I CCS, de sidste trin kræver høje temperaturer, som opnås ved at bruge noget af kraftværkets elektriske effekt. Gallant spekulerede på, om hendes hold i stedet kunne bruge elektrokemiske reaktioner til at adskille CO 2 fra aminen - og fortsæt derefter reaktionen for at lave et fast stof, CO 2 - indeholdende produkt. Hvis så, bortskaffelsesprocessen ville være enklere end den er for gasformig CO 2 . CO 2 ville være tættere pakket, så det ville fylde mindre, og den kunne ikke undslippe, så det ville være mere sikkert. Endnu bedre, yderligere elektrisk energi kan udvindes fra enheden, når den aflades og danner det faste materiale. "Visionen var at sætte en batterilignende enhed i kraftværkets affaldsstrøm for at binde den opfangede CO 2 i et stabilt fast stof, mens man høster den energi, der frigives i processen, " siger Gallant.
Forskning i CCS-teknologi har skabt en god forståelse af den kulstofopsamlingsproces, der finder sted inde i et CCS-system. Når CO 2 tilsættes til en aminopløsning, molekyler af de to arter kombineres spontant for at danne et "addukt, " en ny kemisk art, hvor de oprindelige molekyler forbliver stort set intakte. I dette tilfælde, adduktet dannes, når et carbonatom i en CO 2 molekyle binder sig kemisk til et nitrogenatom i et aminmolekyle. Når de kombineres, CO 2 molekyle er rekonfigureret:Det ændrer sig fra dets oprindelige, meget stabil, lineær form til en "bøjet" form med en negativ ladning - en meget reaktiv form, der er klar til yderligere reaktion.
I hendes skema, Gallant foreslog at bruge elektrokemi til at adskille CO 2 -aminaddukt - lige ved carbon-nitrogen-bindingen. At spalte adduktet ved den binding ville adskille de to stykker:aminen i sin oprindelige ureageret tilstand, klar til at fange mere CO 2 , og den bøjede, kemisk reaktiv form af CO 2 , som så kan reagere med elektronerne og positivt ladede lithiumioner, der strømmer under batteriafladning. Resultatet af denne reaktion kunne være dannelsen af lithiumcarbonat (Li 2 CO 3 ), som ville aflejre sig på kulelektroden.
På samme tid, reaktionerne på kulstofelektroden skulle fremme strømmen af elektroner under batteriafladning - selv uden en metalkatalysator. "Afladningen af batteriet ville ske spontant, " siger Gallant. "Og vi ville bryde adduktet på en måde, der giver os mulighed for at forny vores CO 2 absorber, mens du tager CO 2 til en stald, fast form."
En opdagelsesproces
I 2016 Galant og maskiningeniør doktorand Aliza Khurram begyndte at udforske den idé.
Deres første udfordring var at udvikle en ny elektrolyt. En lithium-CO 2 Batteriet består af to elektroder - en anode lavet af lithium og en katode lavet af kulstof - og en elektrolyt, en løsning, der hjælper med at transportere ladede partikler frem og tilbage mellem elektroderne, når batteriet oplades og aflades. For deres system, de havde brug for en elektrolyt lavet af amin plus opsamlet CO 2 opløst i et opløsningsmiddel - og det var nødvendigt for at fremme kemiske reaktioner på kulstofkatoden, når batteriet aflades.
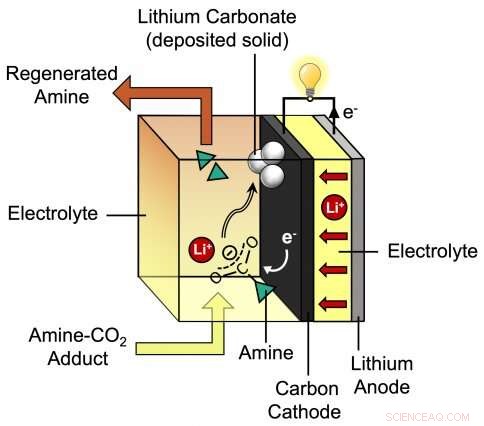
Dette diagram viser processen under afladning af det nye lithium-CO2-batteri udviklet af MIT Assistant Professor Betar Gallant og hendes gruppe. Forskernes foreslåede batteri består af en lithiumanode plus en kulstofkatode, der er omgivet af en speciel elektrolyt, der indeholder lithiumioner (Li+) og amin. Kredit:Massachusetts Institute of Technology
De startede med at teste mulige opløsningsmidler. De blandede deres CO 2 -absorberer amin med en række opløsningsmidler, der ofte bruges i batterier og derefter boblet CO 2 gennem den resulterende opløsning for at se, om CO 2 kunne opløses i høje koncentrationer i dette utraditionelle kemiske miljø. Ingen af amin-opløsningsmiddelopløsningerne udviste observerbare ændringer, når CO 2 Blev introduceret, tyder på, at de alle kan være levedygtige solventkandidater.
Imidlertid, for at enhver elektrokemisk enhed kan fungere, elektrolytten skal tilsættes et salt for at give positivt ladede ioner. Fordi det er et lithium batteri, forskerne startede med at tilsætte et lithiumbaseret salt - og forsøgsresultaterne ændrede sig dramatisk. Med de fleste af de solvente kandidater, tilsætning af saltet forårsagede øjeblikkeligt, at blandingen enten dannede faste bundfald eller til at blive meget viskøse - resultater, der udelukkede dem som levedygtige opløsningsmidler. Den eneste undtagelse var opløsningsmidlet dimethylsulfoxid, eller DMSO. Selv når lithiumsaltet var til stede, DMSO'en kunne opløse aminen og CO 2 .
"Vi fandt ud af, at det lithiumbaserede salt tilfældigvis var vigtigt for at gøre det muligt for reaktionen at fortsætte, " siger Gallant. "Der er noget ved den positivt ladede lithiumion, der kemisk koordinerer med amin-CO 2 addukt, og sammen udgør disse arter den elektrokemisk reaktive art."
Udforsker batteriets adfærd under afladning
For at undersøge udledningsadfærden af deres system, forskerne opstillede en elektrokemisk celle bestående af en lithiumanode, en carbon katode, og deres specielle elektrolyt - for nemheds skyld, allerede fyldt med CO 2 . De sporede derefter udladningsadfærd ved carbonkatoden.
Som de havde håbet, deres specielle elektrolyt fremmede faktisk udledningsreaktion i testcellen. "Med aminen inkorporeret i den DMSO-baserede elektrolyt sammen med lithiumsaltet og CO 2 , vi ser meget høje kapaciteter og betydelige afladningsspændinger - næsten tre volt, " siger Gallant. Baseret på disse resultater, de konkluderede, at deres system fungerer som en lithium-CO 2 batteri med kapaciteter og afladningsspændinger, der er konkurrencedygtige med de avancerede lithium-gas-batterier.
Det næste trin var at bekræfte, at reaktionerne faktisk adskilte aminen fra CO 2 og fortsætter reaktionen for at lave CO 2 -afledte produkter. At finde ud af, forskerne brugte en række værktøjer til at undersøge de produkter, der blev dannet på kulstofkatoden.

Dette scanning elektronmikroskop (SEM) billede viser katoden fra forskernes lithium-kuldioxid-system efter afladning. Analyse af de sfæriske strukturer bekræfter, at de er sammensat af Li2CO3. Indsatsen viser et SEM-billede af carbonkatoden før afladning. Fravær af sfærerne bekræfter, at de blev dannet under udledning. Kredit:Massachusetts Institute of Technology
I en test, de producerede billeder af post-reaktion katode overflade ved hjælp af et scanning elektronmikroskop (SEM). Umiddelbart var sfæriske formationer med en karakteristisk størrelse på 500 nanometer, regelmæssigt fordelt på katodens overflade. Ifølge Gallant, den observerede sfæriske struktur af udledningsproduktet svarede til formen af Li 2 CO 3 observeret i andre lithium-baserede batterier. Disse sfærer var ikke tydelige i SEM-billeder af den "urørte" carbonkatode taget før reaktionerne fandt sted.
Andre analyser bekræftede, at det faste stof aflejret på katoden var Li 2 CO 3 . Det omfattede kun CO 2 -afledte materialer; ingen aminmolekyler eller produkter afledt af dem var til stede. Taget sammen, disse data giver stærke beviser for, at den elektrokemiske reduktion af CO 2 -ladet amin sker gennem den selektive spaltning af carbon-nitrogen-bindingen.
"Aminen kan opfattes som effektivt at tænde for CO'ens reaktivitet 2 , " siger Gallant. "Det er spændende, fordi den amin, der almindeligvis bruges i CO 2 capture kan derefter udføre to kritiske funktioner. Det kan fungere som absorber, spontant hente CO 2 fra forbrændingsgasser og inkorporerer det i elektrolytopløsningen. Og det kan aktivere CO 2 for yderligere reaktioner, der ikke ville være mulige, hvis aminen ikke var der."
Fremtidige retninger
Gallant understreger, at det hidtidige arbejde kun repræsenterer et proof-of-concept-studie. "Der er stadig meget grundlæggende videnskab at forstå, " hun siger, før forskerne kan optimere deres system.
Hun og hendes team fortsætter med at undersøge de kemiske reaktioner, der finder sted i elektrolytten, såvel som den kemiske sammensætning af adduktet, der dannes - "reaktanttilstanden", som den efterfølgende elektrokemi udføres på. De undersøger også den detaljerede rolle af saltsammensætningen.
Ud over, der er praktiske bekymringer at overveje, når de tænker på enhedsdesign. Et vedvarende problem er, at den faste aflejring hurtigt tilstopper kulstofkatoden, så yderligere kemiske reaktioner kan ikke forekomme. I en konfiguration undersøger de - et genopladeligt batteridesign - katoden afdækkes under hver afladnings-opladningscyklus. Reaktioner under udledning afsætter den faste Li 2 CO 3 , og reaktioner under opladning løfter den af, sætte lithium-ionerne og CO 2 tilbage i elektrolytten, klar til at reagere og generere mere elektricitet. Imidlertid, den fangede CO 2 er så tilbage i sin oprindelige gasform i elektrolytten. Forsegling af batteriet ville låse den CO 2 inde, væk fra atmosfæren - men kun så meget CO 2 kan opbevares i et givet batteri, så den samlede effekt af at bruge batterier til at opfange CO 2 emissioner ville være begrænset i dette scenarie.

Forskerne bruger denne opsætning til at teste deres batteriers lagerkapacitet og afladningsspænding. Kredit:Stuart Darsch
Den anden konfiguration, som forskerne undersøger - en opsætning, der kun er udledning - løser dette problem ved aldrig at tillade den gasformige CO 2 at omforme. "Vi er maskiningeniører, så det, vi virkelig gerne vil gøre, er at udvikle en industriel proces, hvor du på en eller anden måde mekanisk eller kemisk kan høste det faste stof, som det dannes, " siger Gallant. "Forestil dig, hvis du ved mekanisk vibration forsigtigt kunne fjerne det faste stof fra katoden, holde det klart for vedvarende reaktion." Placeret i en udstødningsstrøm, et sådant system kunne kontinuerligt fjerne CO 2 emissioner, producerer elektricitet og måske producerer værdifulde faste materialer på samme tid.
Gallant og hendes team arbejder nu på begge konfigurationer af deres system. "Vi ved ikke, hvad der er bedst til applikationer endnu, " siger hun. Mens hun mener, at praktisk lithium-CO 2 batterier er stadig år væk, hun er begejstret for de tidlige resultater, hvilket tyder på, at udvikling af nye elektrolytter til at præaktivere CO 2 kan føre til alternativ CO 2 reaktionsveje. Og hun og hendes gruppe arbejder allerede på nogle.
Et mål er at erstatte lithium med et metal, der er billigere og mere jordrigt, såsom natrium eller calcium. Med startfinansiering fra MIT Energy Initiative, holdet er allerede begyndt at se på et system baseret på calcium, et materiale, der endnu ikke er veludviklet til batteriapplikationer. Hvis calcium-CO 2 opsætningen fungerer som de forudsiger, det faste stof, der dannes, ville være calciumcarbonat - en stentype, der nu er meget brugt i byggeindustrien.
I mellemtiden, Gallant og hendes kolleger er glade for, at de har fundet, hvad der ser ud til at være en ny klasse af reaktioner til indfangning og sekvestrering af CO 2 . "CO 2 konvertering er blevet undersøgt bredt gennem mange årtier, " hun siger, "så vi er glade for at tro, at vi måske har fundet noget, der er anderledes og giver os et nyt vindue til at udforske dette emne."
Denne historie er genudgivet med tilladelse fra MIT News (web.mit.edu/newsoffice/), et populært websted, der dækker nyheder om MIT-forskning, innovation og undervisning.
 Varme artikler
Varme artikler
-
 Forskere viser punktdefekter i katodekrystaller kan fremskynde lithiumabsorptionEn illustration viser et batteris katode, der gennemgår faseovergang fra jernfosfat (FP) til lithiumjernfosfat (LFP) under opladning. Simuleringer fra Rice University-forskere viste, at tilføjelse af
Forskere viser punktdefekter i katodekrystaller kan fremskynde lithiumabsorptionEn illustration viser et batteris katode, der gennemgår faseovergang fra jernfosfat (FP) til lithiumjernfosfat (LFP) under opladning. Simuleringer fra Rice University-forskere viste, at tilføjelse af -
 Simuleringer identificerer betydningen af gitterforvrængninger i ionledende brændselscellemateri…Illustrationerne viser, hvordan sammenhængen mellem gitterforvrængning og protonbindingsenergi i et materiale påvirker protonledning i forskellige miljøer. At formindske denne interaktion kan hjælpe f
Simuleringer identificerer betydningen af gitterforvrængninger i ionledende brændselscellemateri…Illustrationerne viser, hvordan sammenhængen mellem gitterforvrængning og protonbindingsenergi i et materiale påvirker protonledning i forskellige miljøer. At formindske denne interaktion kan hjælpe f -
 "What Is Gibberellic Acid?, 3, [[ Gibberellinsyre (GA) er en slags hormon, der er vigtig for plantevækst. Den grønne revolution i landbruget forekom hovedsageligt på grund af anvendelsen af gibberellinsyre på afgrøder.
"What Is Gibberellic Acid?, 3, [[ Gibberellinsyre (GA) er en slags hormon, der er vigtig for plantevækst. Den grønne revolution i landbruget forekom hovedsageligt på grund af anvendelsen af gibberellinsyre på afgrøder. -
 Fiskeaffald som råmateriale til industrivarerForskere Revilija Mozuraityte og Rasa Slizyte i SINTEF-laboratoriet, hvor de analyserer olier, gelatine, og smagsneutrale proteiner afledt af de resterende råvarer efter laksefiletering. Kredit:Håvard
Fiskeaffald som råmateriale til industrivarerForskere Revilija Mozuraityte og Rasa Slizyte i SINTEF-laboratoriet, hvor de analyserer olier, gelatine, og smagsneutrale proteiner afledt af de resterende råvarer efter laksefiletering. Kredit:Håvard
- Kunne gamle knogler tyde på, at julemanden var ægte?
- Storbritannien når en rigtig god milepæl på dage uden kul
- Landmænd stiger i stigende grad på landbrugsentreprenører, ny forskning viser
- Er den afdøde Stephen Hawkings religiøse overbevisning typisk for britiske videnskabsmænd?
- Billede:Kwanzaa tholus på Ceres
- Ny undersøgelse forudsiger koralblegning og koralspisende søstjerneinvasioner måneder i forvejen


