Hvilken alkohol har et kogepunkt, der er tættest på hexan?
Forståelse af kogepunkt tendenser
* molekylvægt: Større molekyler har generelt højere kogepunkter, fordi de har flere elektroner og stærkere London -spredningskræfter.
* Hydrogenbinding: Alkoholer kan danne stærke brintbindinger, hvilket markant øger kogepunkterne.
* Filial: Forgrening i et molekyle mindsker overfladearealet, reducerer London -spredningskræfter og sænker kogepunkter.
Lad os analysere
* hexan (C6H14): En ikke -polær alkan med et kogepunkt på 69 ° C.
* Alkoholer: De har en -OH -gruppe, der er i stand til hydrogenbinding.
Sammenligning af alkoholer
* methanol (CH3OH): Mindste alkohol, lavt kogepunkt.
* ethanol (C2H5OH): Lidt større, højere kogepunkt.
* propanol (C3H7OH): Endnu større, højere kogepunkt.
* butanol (C4H9OH): Større stadig højere kogepunkt.
svaret
Kogningspunkterne for alkoholer stiger, når kulstofkæden længde øges. Da hexan er et relativt lille molekyle, er vi nødt til at se efter en lille alkohol.
ethanol (C2H5OH) har et kogepunkt på 78 ° C, hvilket er tættest på kogepunktet for hexan (69 ° C).
Vigtig note: Mens ethanol er det tætteste, er det stadig vigtigt at huske, at hydrogenbinding markant øger alkoholens kogepunkter sammenlignet med ikke -polære alkaner som hexan.
Sidste artikelHvilke elementer er i jernoxid?
Næste artikelHvad er farverne på sølvmetal og kobbernitrat i vand?
 Varme artikler
Varme artikler
-
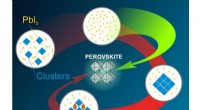 Kemikere bestemmer, hvordan man undgår biprodukter i syntesen af perovskitterRUDN -kemikere fandt ud af, hvordan man undgår biprodukter i syntesen af Perovskites Kredit:Natalia Deryugina En RUDN -professor, sammen med sine kolleger fra andre universiteter i Moskva, har b
Kemikere bestemmer, hvordan man undgår biprodukter i syntesen af perovskitterRUDN -kemikere fandt ud af, hvordan man undgår biprodukter i syntesen af Perovskites Kredit:Natalia Deryugina En RUDN -professor, sammen med sine kolleger fra andre universiteter i Moskva, har b -
 Havvand giver de første gram gulkage:Garnlignende materiale opsamler den største mængde uran til …Dette første gram gulkage blev fremstillet af uran fanget fra havvand med modificeret garn. Chien Wai og kolleger hos LCW Supercritical Technologies producerede den gule kage, en pulveriseret form for
Havvand giver de første gram gulkage:Garnlignende materiale opsamler den største mængde uran til …Dette første gram gulkage blev fremstillet af uran fanget fra havvand med modificeret garn. Chien Wai og kolleger hos LCW Supercritical Technologies producerede den gule kage, en pulveriseret form for -
 Forskere skabte spiselige film til fødevareemballageRammohan Aluru (til venstre) og Grigory Zyryanov (til højre) i forskningsgruppen skabte spiselige madfilm på tangen. Kredit:UrFU / Andrei Fomin En international gruppe af forskere fra Indien og Ru
Forskere skabte spiselige film til fødevareemballageRammohan Aluru (til venstre) og Grigory Zyryanov (til højre) i forskningsgruppen skabte spiselige madfilm på tangen. Kredit:UrFU / Andrei Fomin En international gruppe af forskere fra Indien og Ru -
 Nyt cellulosebaseret materiale repræsenterer tre sensorer i énPh.d. -studerende Shaobo Han med sensoren, der kan måle tryk, temperatur og luftfugtighed på samme tid. Kredit:Thor Balkhed Cellulose gennemblødt i en omhyggeligt designet polymerblanding fungerer
Nyt cellulosebaseret materiale repræsenterer tre sensorer i énPh.d. -studerende Shaobo Han med sensoren, der kan måle tryk, temperatur og luftfugtighed på samme tid. Kredit:Thor Balkhed Cellulose gennemblødt i en omhyggeligt designet polymerblanding fungerer
- Er kviksølv indre eller ydre af solsystemet?
- Ny smart polymer lyser klarere, når den strækkes
- Hvad betyder sandsten akvifer?
- Hvad er portionsudbytte?
- Billede:Teknikere sikrer, at James Webb Space Telescopes solskjold overlever belastninger, der oplev…
- Et kemisk fingerpeg om, hvordan livet startede på Jorden


