Hvorfor kloroxid har et lavt smeltepunkt?
Lad os dog analysere, hvorfor * lignende * forbindelser, som Cl₂o, har lave smeltepunkter:
* svage intermolekylære kræfter: CL₂O er et kovalent molekyle med en relativt lav molekylær vægt. De primære intermolekylære kræfter, der holder CL₂O -molekyler sammen, er svage van der Waals -styrker. Disse kræfter overvindes let af termisk energi, hvilket resulterer i et lavt smeltepunkt.
* Polaritet: Mens CL₂O er et polært molekyle, er dets dipolmoment relativt lille. Dette betyder, at de elektrostatiske attraktioner mellem molekyler er svagere end i stærkt polære forbindelser, hvilket yderligere bidrager til et lavt smeltepunkt.
* struktur: Strukturen af CL₂O er bøjet, hvilket fører til svagere intermolekylære interaktioner end i lineære eller mere symmetriske molekyler.
Kortfattet: Kombinationen af svage intermolekylære kræfter, lav molekylvægt og relativt lille dipolmoment resulterer i et lavt smeltepunkt for CL₂O.
Husk, at CLO er en radikal og ikke har et defineret smeltepunkt.
 Varme artikler
Varme artikler
-
 Lad det regne! Nye belægninger gør naturlige stoffer vandtætteAfvisning af forskellige væsker på polyesterstof belagt med H1F7Ma-co-DVB:sojasovs (sort dråbe), kaffe (brun dråbe), HCl -syre (øverste venstre gennemsigtige dråbe), NaOH (gennemsigtig dråbe nederst t
Lad det regne! Nye belægninger gør naturlige stoffer vandtætteAfvisning af forskellige væsker på polyesterstof belagt med H1F7Ma-co-DVB:sojasovs (sort dråbe), kaffe (brun dråbe), HCl -syre (øverste venstre gennemsigtige dråbe), NaOH (gennemsigtig dråbe nederst t -
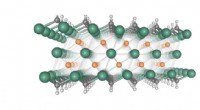 Tager 2D-materialer til MAXMXener er dækket med metal-oxygen og metal-hydroxyl (f.eks. Ti-OH) bindinger, som er kemisk og elektrokemisk aktive. Kredit:KAUST Opdaget af forskere ved Drexel University som elektroder til energ
Tager 2D-materialer til MAXMXener er dækket med metal-oxygen og metal-hydroxyl (f.eks. Ti-OH) bindinger, som er kemisk og elektrokemisk aktive. Kredit:KAUST Opdaget af forskere ved Drexel University som elektroder til energ -
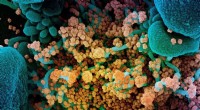 Forskere opdager SARS-CoV-2-hæmmereFarvelagt scanningselektronmikrofotografi af en døende celle (blå) stærkt inficeret med SARS-CoV-2 (gul), virus, der forårsager COVID-19. Kredit:NIAID Integrated Research Facility, Fort Detrick, Maryl
Forskere opdager SARS-CoV-2-hæmmereFarvelagt scanningselektronmikrofotografi af en døende celle (blå) stærkt inficeret med SARS-CoV-2 (gul), virus, der forårsager COVID-19. Kredit:NIAID Integrated Research Facility, Fort Detrick, Maryl -
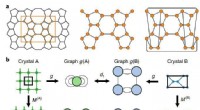 En ny matematisk tilgang til forståelse af zeolitterGraph og supercell matching. en, Repræsentation af en zeolit ved hjælp af en graf (til venstre). Enhedscellegrafen (midten) modificeres for at opfylde periodiske grænsebetingelser ved at sløjfe bind
En ny matematisk tilgang til forståelse af zeolitterGraph og supercell matching. en, Repræsentation af en zeolit ved hjælp af en graf (til venstre). Enhedscellegrafen (midten) modificeres for at opfylde periodiske grænsebetingelser ved at sløjfe bind
- Hvordan sparer en remskive energi?
- Markerede en betydelig kølig besværgelse Megafaunas død?
- Hvordan måler jeg Lux Lighting?
- Forskere sætter ichthyosaurer i virtuelle vandtanke
- Hvor kan man købe alun til dyrkning af saltkrystaller?
- Skoler har en afgørende rolle at spille i at støtte unge, der flygter fra væbnede konflikter


