Hvad er forskellen mellem uorganiske forbindelser og organiske forbindelser?
uorganiske forbindelser:
* sammensætning: Primært sammensat af andre elementer end kulstof, såsom mineraler, salte, metaller og gasser. Selvom de kan indeholde kulstof, er det ikke det definerende kendetegn ved molekylet.
* struktur: Har generelt enkle strukturer og stærke ioniske bindinger.
* egenskaber: Har ofte høje smelte- og kogepunkter, er generelt ikke brandfarlige og er ofte opløselige i vand.
* Eksempler: Vand (H₂O), bordsalt (NaCl), kuldioxid (CO₂), jernoxid (Fe₂o₃)
organiske forbindelser:
* sammensætning: Indehold altid kulstof og normalt brint. De indeholder ofte andre elementer som ilt, nitrogen, svovl, fosfor og halogener.
* struktur: Komplekse strukturer, normalt bygget omkring en rygrad af carbonatomer, der er forbundet sammen i kæder eller ringe.
* egenskaber: Generelt har lavere smelte- og kogepunkter, er ofte brandfarlige og er normalt ikke opløselige i vand.
* Eksempler: Glukose (c₆h₁₂o₆), methan (ch₄), ethanol (c₂h₅oh), proteiner, fedt, kulhydrater.
her er en simpel analogi:
Forestil dig, at du bygger med Legos.
* uorganiske forbindelser er som at bygge med kun et par basale mursten (andre elementer end kulstof). De kan skabe enkle strukturer.
* organiske forbindelser er som at bygge med en lang række mursten (kulstof, brint, ilt osv.) Og specielle stik. De kan skabe utroligt komplekse og indviklede strukturer.
nøglepunkter at huske:
* Mens sondringen generelt er nyttig, er der nogle undtagelser. For eksempel betragtes kuldioxid (CO₂) uorganisk på trods af at der indeholder kulstof.
* Organiske forbindelser er normalt forbundet med levende organismer, mens uorganiske forbindelser findes i den ikke-levende verden.
Fortæl mig, hvis du vil vide mere om specifikke eksempler på uorganiske og organiske forbindelser!
 Varme artikler
Varme artikler
-
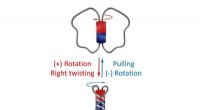 Alle afviklede:En reversibel molekylær hvirvelDenne molekylære hvirvel kan vrides reversibelt, og forskere kan måle dens kræfter. Kredit:Tilpasset fra Journal of the American Chemical Society (2022), DOI:10.1021/jacs.2c02547 I løbet af de sids
Alle afviklede:En reversibel molekylær hvirvelDenne molekylære hvirvel kan vrides reversibelt, og forskere kan måle dens kræfter. Kredit:Tilpasset fra Journal of the American Chemical Society (2022), DOI:10.1021/jacs.2c02547 I løbet af de sids -
 Hårde magnetiske belægninger til højpræcisionsmikroskopiMikroskopplade med magnetisk positionering. Kredit:ITK Dr. Kassen GmbH Mikroskopi er i spidsen for kampen mod coronavirus. Specielle mikroskoper, som gør det muligt for forskere at se små cellestr
Hårde magnetiske belægninger til højpræcisionsmikroskopiMikroskopplade med magnetisk positionering. Kredit:ITK Dr. Kassen GmbH Mikroskopi er i spidsen for kampen mod coronavirus. Specielle mikroskoper, som gør det muligt for forskere at se små cellestr -
 Her er et twist til en ældgammel klassiker:Laktosefri chokolademælkTo nordøstlige kandidater har bragt skifer, deres mærke af laktosefri chokolademælk, på hylderne i mere end 300 dagligvarebutikker langs østkysten. Kredit:Matthew Modoono/Northeastern University F
Her er et twist til en ældgammel klassiker:Laktosefri chokolademælkTo nordøstlige kandidater har bragt skifer, deres mærke af laktosefri chokolademælk, på hylderne i mere end 300 dagligvarebutikker langs østkysten. Kredit:Matthew Modoono/Northeastern University F -
 3-D atomstruktur af TRPML1 ionkanal offentliggjortIllustrationen viser det undersøgte protein indlejret i en nanodisk struktur (øverst til venstre) og tre visninger af TRPML1-ionkanalen fra forskellige vinkler. Kredit:UT Southwestern Forskere fra
3-D atomstruktur af TRPML1 ionkanal offentliggjortIllustrationen viser det undersøgte protein indlejret i en nanodisk struktur (øverst til venstre) og tre visninger af TRPML1-ionkanalen fra forskellige vinkler. Kredit:UT Southwestern Forskere fra
- Hvordan reproducerer alger?
- Hvad siger Bernoullis -princippet om hastigheden af en bevægelig væske?
- NASA entreprenør afgør whistleblower-klage for $375, 000
- Antropocæn vs Meghalayan - hvorfor geologer kæmper om, hvorvidt mennesker er en naturkraft
- Sådan fungerer dyreforsøg
- Metalsæber er kritiske i hastigheden af forringelse af oliemalerier


