Hvad er en hovedårsag til, at en stigning i temperaturen øger hastigheden for kemisk reaktion?
Sådan fungerer det:
* Øget kinetisk energi: Når du opvarmer et system, øger du den gennemsnitlige kinetiske energi for molekylerne. Dette betyder, at de bevæger sig hurtigere og kolliderer med hinanden oftere.
* mere effektive kollisioner: For at en kemisk reaktion kan forekomme, skal molekyler kollidere med nok energi og i den rigtige orientering. Højere kinetisk energi betyder:
* Flere kollisioner: Molekylerne bevæger sig hurtigere, hvilket øger chancen for, at de støder på hinanden.
* flere energiske kollisioner: Kollisionerne er mere kraftfulde, hvilket gør det mere sandsynligt, at de vil overvinde den aktiveringsenergibarriere, der er nødvendig for, at reaktionen kan forekomme.
Aktiveringsenergi: Dette er den mindste mængde energi, der kræves for at en reaktion skal starte. Den øgede kinetiske energi fra højere temperaturer giver flere molekyler den nødvendige energi til at overvinde denne barriere.
Tænk på det sådan: Forestil dig, at du prøver at skubbe en tung klippe op ad bakke. Jo højere dit energiniveau (som når du løber), desto mere sandsynligt er det, at du med succes skubber klippen over bakken. I denne analogi repræsenterer klippen aktiveringsenergibarrieren, og dit energiniveau repræsenterer molekylernes kinetiske energi.
Bemærk: Mens temperatur er en vigtig faktor, kan andre variabler som koncentrationen af reaktanter og tilstedeværelsen af katalysatorer også væsentligt påvirke hastigheden for en kemisk reaktion.
 Varme artikler
Varme artikler
-
 Miniproteiner, der kan lancere tostrengede angreb på virale proteinerDimerisering af spidsprotein med to-sidet peptid. Kredit:Bhavesh Khatri Den hurtige fremkomst af nye stammer af SARS-CoV-2-viruset har formindsket beskyttelsen fra COVID-19-vacciner. En ny tilgang
Miniproteiner, der kan lancere tostrengede angreb på virale proteinerDimerisering af spidsprotein med to-sidet peptid. Kredit:Bhavesh Khatri Den hurtige fremkomst af nye stammer af SARS-CoV-2-viruset har formindsket beskyttelsen fra COVID-19-vacciner. En ny tilgang -
 Hurtig og let syntese af antibakteriel aminosyre Schiff-base kobberkomplekserForskere fra Tokyo University of Science brugte en to-trins mikrobølgebestrålingsteknik til at syntetisere aminosyre Schiff base Cu (II) komplekser inden for 10 minutter. De fremstillede baser udviste
Hurtig og let syntese af antibakteriel aminosyre Schiff-base kobberkomplekserForskere fra Tokyo University of Science brugte en to-trins mikrobølgebestrålingsteknik til at syntetisere aminosyre Schiff base Cu (II) komplekser inden for 10 minutter. De fremstillede baser udviste -
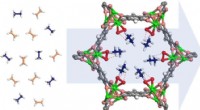 Nyt materiale kunne gøre plastikfremstilling mere energieffektivDenne jernbaserede metal-organiske ramme dekoreret med peroxo-grupper (røde og grønne) kan fange ethan (blå molekyler), mens den tillader ethylen (ferskenmolekyler) at passere igennem, potentielt give
Nyt materiale kunne gøre plastikfremstilling mere energieffektivDenne jernbaserede metal-organiske ramme dekoreret med peroxo-grupper (røde og grønne) kan fange ethan (blå molekyler), mens den tillader ethylen (ferskenmolekyler) at passere igennem, potentielt give -
 Forskere opfinder hurtigere, billigere strategi til design af infrarødt emitterende materialerKredit:Pixabay/CC0 Public Domain Northwestern University forskere har udviklet en ny lavpris, relativt enkel strategi til design af materialer, der bruges til billeddannelse med levende celler, fo
Forskere opfinder hurtigere, billigere strategi til design af infrarødt emitterende materialerKredit:Pixabay/CC0 Public Domain Northwestern University forskere har udviklet en ny lavpris, relativt enkel strategi til design af materialer, der bruges til billeddannelse med levende celler, fo
- Med nye algoritmer kunne dataforskere på få dage opnå, hvad der engang tog måneder
- Hvad kalder du de stenede koniske fremskrivninger, der hænger fra en hule tag?
- Hvad producerer mikrober til at dræbe andre mikrober?
- Græske arkæologer afslører rigdomme, der er overset af røvere
- Hubbles dobbeltgalakseblik:Leda og NGC 4424
- Ligge i sengen for videnskabens skyld


