Hvorfor har heptan et højere kogepunkt end methanol?
1. Molekylær størrelse og overfladeareal:
* heptan (C7H16): Et stort, ikke -polært molekyle med et betydeligt overfladeareal.
* methanol (CH3OH): Et mindre, polært molekyle med et mindre overfladeareal.
2. Van der Waals Forces:
* heptan: På grund af dens størrelse og ikke -polære karakter er Heptane primært afhængig af London -spredningskræfter (en type van der Waals Force). Mens de er svage individuelt, bliver disse kræfter stærkere med stigende overfladeareal, hvilket fører til et højere kogepunkt.
* methanol: Mens methanol kan danne brintbindinger, som er stærkere end van der Waals -styrker, bidrager dens mindre størrelse og svagere London -spredningskræfter samlet til et lavere kogepunkt.
3. Hydrogenbinding:
* methanol: Mens hydrogenbinding er til stede i methanol, er det vigtigt at bemærke, at styrken af hydrogenbinding også påvirkes af størrelsen og polariteten af molekylet. I methanol mindsker den lille størrelse og relativt svage dipolmoment den samlede påvirkning af hydrogenbinding.
Kortfattet:
Den større størrelse og øgede overfladeareal af heptan, der fører til stærkere London -spredningskræfter, opvejer effekten af hydrogenbinding i methanol. Dette resulterer i et højere kogepunkt for heptan.
Sidste artikelHvilke bindinger er polære f-f o-o o-h-h-h?
Næste artikelHvordan skriver du formlen for nikkel III sulfat?
 Varme artikler
Varme artikler
-
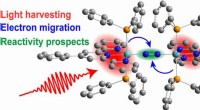 Hvordan sollys giver elektroner energi til at bryde nitrogen og danne ammoniakDen skematiske tegning viser den potentielle aktivering af et nitrogenmolekyle (blå kugler), der er holdt i midten af katalysatoren. Lys høstes (rødt), og elektroner migrerer (blå pile) for i sidste
Hvordan sollys giver elektroner energi til at bryde nitrogen og danne ammoniakDen skematiske tegning viser den potentielle aktivering af et nitrogenmolekyle (blå kugler), der er holdt i midten af katalysatoren. Lys høstes (rødt), og elektroner migrerer (blå pile) for i sidste -
 Radiofrekvensenergi opvarmer interessen for lavtemperatur nanokatalysatorerLouisiana State University-forskere brugte RF-felter til at opvarme jernoxidnanopartikler knyttet til oliemolekyler for at opnå mere energieffektive katalytiske reaktioner. Kredit:ORNL/Genevieve Marti
Radiofrekvensenergi opvarmer interessen for lavtemperatur nanokatalysatorerLouisiana State University-forskere brugte RF-felter til at opvarme jernoxidnanopartikler knyttet til oliemolekyler for at opnå mere energieffektive katalytiske reaktioner. Kredit:ORNL/Genevieve Marti -
 Forskere søger at udvikle antiviral membranmaskeUniversity of Kentucky-forsker Dibakar Bhattacharyya har konceptet og midlerne til at udvikle en medicinsk ansigtsmaske, der vil fange og deaktivere COVID-19-virussen ved kontakt. Kredit:University of
Forskere søger at udvikle antiviral membranmaskeUniversity of Kentucky-forsker Dibakar Bhattacharyya har konceptet og midlerne til at udvikle en medicinsk ansigtsmaske, der vil fange og deaktivere COVID-19-virussen ved kontakt. Kredit:University of -
 Kemisk tiltrækning giver klapperslange peptid bid på superbugsKredit:University of Queensland Forskere har vist, hvorfor et fragment af et protein fra klappekirtlen hos klapperslanger kunne være grundlaget for et alternativ til konventionelle antibiotika. U
Kemisk tiltrækning giver klapperslange peptid bid på superbugsKredit:University of Queensland Forskere har vist, hvorfor et fragment af et protein fra klappekirtlen hos klapperslanger kunne være grundlaget for et alternativ til konventionelle antibiotika. U
- Dimensionerne af en NEMA 56C
- Påvirker medieeksponering en persons risiko for radikalisering?
- Hvad er forholdet mellem reaktionens hastighed og hastigheden af dannelsen af produkter?
- Hvorfor produceres basalter på divergerende pladegrænser?
- Hvordan indebærer loven om bevaringsenergi en overførsel?
- Hvordan er gravitationslinse relateret til mørkt stof, og hvilke konsekvenser har dette forhold for…


