Hvilke bindinger er polære f-f o-o o-h-h-h?
* f-f (fluorfluorin): ikke -polær
* Fluoratomer har den samme elektronegativitet, hvilket betyder, at de trækker elektroner lige på.
* Bindingen er symmetrisk, og der er ingen forskel i gebyrfordeling.
* o-o (ilt-oxygen): ikke -polær
* I lighed med F-F har iltatomer den samme elektronegativitet.
* Bindingen er symmetrisk.
* o-H (ilt-hydrogen): polar
* Oxygen er meget mere elektronegativ end brint.
* Dette skaber en delvis negativ ladning (Δ-) på iltatomet og en delvis positiv ladning (δ+) på hydrogenatomet.
* h-h (hydrogen-hydrogen): ikke -polær
* Hydrogenatomer har den samme elektronegativitet.
* Bindingen er symmetrisk.
Nøglekoncept:Elektronegativitet
Elektronegativitet er et atoms evne i et molekyle til at tiltrække elektroner. Jo højere elektronegativitetsforskellen mellem to bundne atomer, jo mere polær er bindingen.
Sidste artikelHvad er nogle fordele og ulemper på benzen?
Næste artikelHvorfor har heptan et højere kogepunkt end methanol?
 Varme artikler
Varme artikler
-
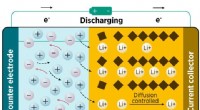 Røntgenanalyse afslører opladningsmekanismen for et lovende elektrodematerialeEn titaniumdioxidelektrode optager lithiumioner, når batteriet aflades. Kredit:Ref. 1. © 2018 Wiley-VCH Verlag GmbH &Co. KGaA, Weinheim En eksperimentel teknik udviklet af A*STAR-forskere er bleve
Røntgenanalyse afslører opladningsmekanismen for et lovende elektrodematerialeEn titaniumdioxidelektrode optager lithiumioner, når batteriet aflades. Kredit:Ref. 1. © 2018 Wiley-VCH Verlag GmbH &Co. KGaA, Weinheim En eksperimentel teknik udviklet af A*STAR-forskere er bleve -
 Neutronstråle fra atomreaktor bruges til at producere sikrere bilerPrøveklemningstrin på hexapod -bevægelig platform for at muliggøre præcis prøveoversættelse gennem neutronstråle. Kredit:University of Warwick Et partnerskab ledet af WMG ved University of Warwick
Neutronstråle fra atomreaktor bruges til at producere sikrere bilerPrøveklemningstrin på hexapod -bevægelig platform for at muliggøre præcis prøveoversættelse gennem neutronstråle. Kredit:University of Warwick Et partnerskab ledet af WMG ved University of Warwick -
 En nyopdaget, naturlig te-koffeinfattig te-planteBlade og unge skud af en sjælden vild te, der er lav i koffein. Kredit:American Chemical Society Te -drikkere, der søger den populære drikkes beroligende smag uden dets eksplosive koffeinstød, kan
En nyopdaget, naturlig te-koffeinfattig te-planteBlade og unge skud af en sjælden vild te, der er lav i koffein. Kredit:American Chemical Society Te -drikkere, der søger den populære drikkes beroligende smag uden dets eksplosive koffeinstød, kan -
 Nylige fremskridt inden for optimering af dispergerede platinkatalysatorerIndfødt platinklump, lokalitet Kondyor mine, Khabarovsk Krai, Rusland. Kredit:Wikipedia. Meget spredte platinkatalysatorer giver nye muligheder for industrielle processer, såsom den flammeløse for
Nylige fremskridt inden for optimering af dispergerede platinkatalysatorerIndfødt platinklump, lokalitet Kondyor mine, Khabarovsk Krai, Rusland. Kredit:Wikipedia. Meget spredte platinkatalysatorer giver nye muligheder for industrielle processer, såsom den flammeløse for
- Ny indsigt i, hvordan fugleinfluenza krydser artsbarrieren
- Er astrologi et naturvidenskab eller anon -naturligt studieretning?
- Revolveres solen om noget?
- Hvordan Molecular Scissors kan løse sygdomme og redigere DNA
- Hvilken funktion har phenolphtalein ved titrering?
- Blinkede nanodiamanter er kun en fase, forskerholdet finder


