Hvor mange mol ammoniumioner er der i 8,754g carbonat?
* ammoniumioner (NH₄⁺) og carbonationer (CO₃⁻²) er ikke direkte relaterede. De danner forskellige forbindelser. For at finde antallet af ammoniumioner har du brug for en forbindelse indeholdende ammonium.
Her er, hvordan man nærmer sig denne type problem:
1. Identificer forbindelsen: Du skal kende den specifikke forbindelse, der indeholder ammoniumioner, som du arbejder med (f.eks. Ammoniumcarbonat, ammoniumchlorid osv.).
2. Find den molære masse: Beregn den molære masse af forbindelsen.
3. Konverter masse til mol: Opdel den givne masse af forbindelsen med dens molære masse for at finde antallet af mol af forbindelsen.
4. Bestem molforholdet: Den kemiske formel for forbindelsen fortæller dig forholdet mellem ammoniumioner og forbindelsen. For eksempel er der i ammoniumcarbonat ((NH₄) ₂CO₃) 2 mol ammoniumioner for hver 1 mol ammoniumcarbonat.
5. Beregn mol af ammoniumioner: Multiplicer molen af forbindelsen med molforholdet for at finde molen af ammoniumioner.
Eksempel:
Lad os sige, at du har 8,754 g ammoniumcarbonat ((NH₄) ₂CO₃).
1. molmasse af (nh₄) ₂co₃: (2 * 18,04 g/mol (NH₄)) + 60,01 g/mol (CO₃) =96,09 g/mol
2. mol (nh₄) ₂co₃: 8,754 g / 96,09 g / mol =0,0912 mol
3. molforhold: 2 mol NH₄⁺ / 1 mol (NH₄) ₂co₃
4. mol NH₄⁺: 0,0912 mol (NH₄) ₂CO₃ * (2 mol NH₄⁺ / 1 mol (NH₄) ₂CO₃) =0,1824 mol NH₄⁺
Derfor ville der i dette eksempel være 0,1824 mol ammoniumioner i 8,754 g ammoniumcarbonat.
 Varme artikler
Varme artikler
-
 Enzym -actionfilm viser, hvordan naturen laver penicillinerKredit:CC0 Public Domain Forskere, der er specialiserede i at studere atom-for-atom-koreografi af enzymer, har afsløret ny indsigt i funktionen af isopenicillin N-syntase, et enzym, der er nødve
Enzym -actionfilm viser, hvordan naturen laver penicillinerKredit:CC0 Public Domain Forskere, der er specialiserede i at studere atom-for-atom-koreografi af enzymer, har afsløret ny indsigt i funktionen af isopenicillin N-syntase, et enzym, der er nødve -
 Video:Hvordan kemi gør fjernelse af kuldioxid muligKredit:The American Chemical Society I løbet af de sidste par hundrede år, mængden af kuldioxid i vores atmosfære er steget i vejret. Hvis vi ikke fjerner i det mindste noget af det, der kommer
Video:Hvordan kemi gør fjernelse af kuldioxid muligKredit:The American Chemical Society I løbet af de sidste par hundrede år, mængden af kuldioxid i vores atmosfære er steget i vejret. Hvis vi ikke fjerner i det mindste noget af det, der kommer -
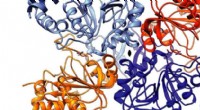 Forskere nedbryder tuberkulosestrukturenKrystalstruktur af det nyligt afbildede enzym med carbonring, der spalter fra tuberkulosebakterien, IpdABMtb. Kredit:Lindsay Eltis Forskere fra University of British Columbia har taget et afgørend
Forskere nedbryder tuberkulosestrukturenKrystalstruktur af det nyligt afbildede enzym med carbonring, der spalter fra tuberkulosebakterien, IpdABMtb. Kredit:Lindsay Eltis Forskere fra University of British Columbia har taget et afgørend -
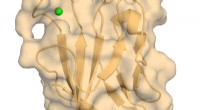 Forskere billede atomstruktur af vigtig immunregulatorHuman TIM-3 med bundet calcium. Kredit:Richard Blumberg, Brigham and Womens Hospital En ny undersøgelse foretaget af efterforskere fra Brigham and Womens Hospital giver en biofysisk og strukturel
Forskere billede atomstruktur af vigtig immunregulatorHuman TIM-3 med bundet calcium. Kredit:Richard Blumberg, Brigham and Womens Hospital En ny undersøgelse foretaget af efterforskere fra Brigham and Womens Hospital giver en biofysisk og strukturel
- Hvorfor er det vigtigt at bevare naturbalancen?
- Hvad er det videnskabelige navn på flaskebørstetræet?
- Hvordan måler forskere planeternes vægte?
- FN advarer om, at den caribiske vulkan kan påvirke andre øer
- Hvorfor mange konservative har et svært forhold til videnskab
- Hvad er et charcter -egenskabskort?


