Hvorfor kan et iltatom ikke danne en tredobbelt binding?
* Valenselektroner: Oxygen har seks valenselektroner (elektroner i sin yderste skal). For at opnå en stabil octet -konfiguration skal den få to flere elektroner.
* limningskapacitet: Hver kovalent binding involverer deling af to elektroner. Oxygen kan maksimalt danne to kovalente bindinger ved hjælp af dens to uparrede valenselektroner.
* Ingen tomme orbitaler: Oxygen's p-orbitaler er alle fyldt med elektroner. Der er ingen tomme orbitaler til rådighed til dannelse af yderligere obligationer.
* frastødning: Triplebindinger involverer betydelig elektrondensitet i bindingsregionen. Afvisningen mellem elektronerne i en tredobbelt binding ville være for høj til, at Oxygen's lille størrelse kan rumme.
Kortfattet: Oxygen's elektronkonfiguration og begrænset bindingskapacitet forhindrer den i at danne tredobbelt obligationer.
 Varme artikler
Varme artikler
-
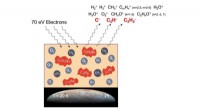 Lifes byggesten observeret i rumlignende omgivelserLavenergi-elektronpåvirkning formidler skabelsen af nye komplekse organiske molekyler, såsom ethanol, i astrofysiske/planetariske modelis indeholdende metan og ilt; mens nogle af de nye arter desorb
Lifes byggesten observeret i rumlignende omgivelserLavenergi-elektronpåvirkning formidler skabelsen af nye komplekse organiske molekyler, såsom ethanol, i astrofysiske/planetariske modelis indeholdende metan og ilt; mens nogle af de nye arter desorb -
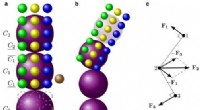 Computermodeller giver ny forståelse af seglcellesygdomEn ny modelleringsteknik gør det muligt for forskere at se, hvad der sker inde i røde blodlegemer, der er ramt af seglcellesygdom. Kredit:Karniadakis lab / Brown University Computermodeller udvikl
Computermodeller giver ny forståelse af seglcellesygdomEn ny modelleringsteknik gør det muligt for forskere at se, hvad der sker inde i røde blodlegemer, der er ramt af seglcellesygdom. Kredit:Karniadakis lab / Brown University Computermodeller udvikl -
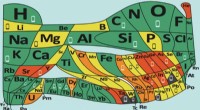 Periodisk system:ny version advarer om elementer, der er truetMenstruationssmerter. Kredit:European Chemical Society Det er fantastisk at tænke på, at alt omkring os består af kun 90 byggesten - de naturligt forekommende kemiske elementer. Dmitri Mendeleev s
Periodisk system:ny version advarer om elementer, der er truetMenstruationssmerter. Kredit:European Chemical Society Det er fantastisk at tænke på, at alt omkring os består af kun 90 byggesten - de naturligt forekommende kemiske elementer. Dmitri Mendeleev s -
 Almindelig brugt kemisk fiksering forårsager aggregeringsartefakterFigur 1. En ny teknik til at observere levende cellemembraner for AFM ved hjælp af porøs siliciumnitridmembran (MPM). (a) Udseendet af MPM. (b) MPM-hullerne observeret af AFM. (c) MPM, når den er sat
Almindelig brugt kemisk fiksering forårsager aggregeringsartefakterFigur 1. En ny teknik til at observere levende cellemembraner for AFM ved hjælp af porøs siliciumnitridmembran (MPM). (a) Udseendet af MPM. (b) MPM-hullerne observeret af AFM. (c) MPM, når den er sat
- Hvor hurtigt rejste Yucatan Asteroid?
- Oxidlag øger ydeevnen i kvantepriksolceller med nanotråd
- Hvilke komprimerede gasser bruges til svejsning?
- Hvad er halvledende bånd, der bruges i strømkabler?
- Når luft afkøles, holder den så meget vanddamp, så gør hvad til en væske eller danner iskrysta…
- Hvordan bliver lys ferskenskaller røde?


