Hvilken reaktion opstår, når brom tilsættes til en vandig opløsning af iodidioner?
Her er den afbalancerede kemiske ligning:
br₂ (aq) + 2i⁻ (aq) → 2Br⁻ (aq) + i₂ (aq)
Her er en sammenbrud af, hvad der sker:
* brom (Br₂) fungerer som oxidant: Det får elektroner og reduceres til bromidioner (BR⁻).
* iodidioner (i⁻) fungerer som reduktionsmiddel: De mister elektroner og oxideres til jodmolekyler (I₂).
Observationer:
* Opløsningen bliver brun på grund af dannelsen af jod.
* Hvis reaktionen udføres i nærvær af stivelse, vil opløsningen blive blå-sort, en karakteristisk reaktion af jod med stivelse.
Nøglekoncept:
Denne reaktion demonstrerer halogenfortrængningsreaktion , hvor en mere reaktiv halogen fortrænger en mindre reaktiv halogen fra dens saltopløsning. Brom er mere reaktiv end jod, derfor kan den fortrænge iodidioner fra opløsningen.
Sidste artikelFlydende brom og nitrogen giver tribromidformel?
Næste artikelHvad er formlen for brom, når den er en væske?
 Varme artikler
Varme artikler
-
 Forskere identificerer overgangsmetal til højeffektiv kuldioxidaktiveringSpektroskopisk identifikation af overgangsmetal M[η 2 -(O, O)C] arter til højeffektiv CO2-aktivering. Kredit:ZHENG Huijun Den atmosfæriske koncentration af kuldioxid (CO 2 ) har været stigende
Forskere identificerer overgangsmetal til højeffektiv kuldioxidaktiveringSpektroskopisk identifikation af overgangsmetal M[η 2 -(O, O)C] arter til højeffektiv CO2-aktivering. Kredit:ZHENG Huijun Den atmosfæriske koncentration af kuldioxid (CO 2 ) har været stigende -
 At sætte fokus på livets maskineriEn sensor på en sensor:Laserlys (rødt) skinner (øverst) ind i en mikroperle af glas, som en guld nanorod er fastgjort til. Laserlyset løber rundt om indersiden af mikroperlen og er koncentreret om g
At sætte fokus på livets maskineriEn sensor på en sensor:Laserlys (rødt) skinner (øverst) ind i en mikroperle af glas, som en guld nanorod er fastgjort til. Laserlyset løber rundt om indersiden af mikroperlen og er koncentreret om g -
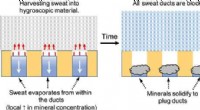 Vende sveden mod sig selv med en metalfri antiperspirantKredit:American Chemical Society Kropslugt er en ubehagelig lugt, produceres, når bakterier, der lever på huden, nedbryder proteinerne i sved. For at undgå at stinke, nogle mennesker anvender anti
Vende sveden mod sig selv med en metalfri antiperspirantKredit:American Chemical Society Kropslugt er en ubehagelig lugt, produceres, når bakterier, der lever på huden, nedbryder proteinerne i sved. For at undgå at stinke, nogle mennesker anvender anti -
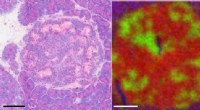 Kortlægning af kræftbevægelserKræftforskere kæmper for at identificere tumorceller, der er spredt i ikke-maligne væv, fordi tumorceller udnytter vævsmiljøet og monopoliserer tilgængelige ressourcer for at fortsætte med at vokse. F
Kortlægning af kræftbevægelserKræftforskere kæmper for at identificere tumorceller, der er spredt i ikke-maligne væv, fordi tumorceller udnytter vævsmiljøet og monopoliserer tilgængelige ressourcer for at fortsætte med at vokse. F
- Hvad er en aurora, og hvordan den dannede sig?
- Videnskabsmand tager nye billeder af Marsmånen Phobos for at hjælpe med at bestemme dens oprindels…
- Hvad er volumenprocenten af ethanol?
- Himalaya -bjergene dannet hvornår?
- Konkurrerende Colorado River-planer viser, at syv stater ikke kan blive enige om, hvordan de skal st…
- Fra biler til Mars:Hvad der er godt for F1, er godt for livet i hele universet


