Hvordan skriver du en afbalanceret ligning til reaktion af svovl med følgende metaller til dannelse af faste stoffer, der kan tage ionisk, når anion er S2?
forståelse af koncepterne
* ioniske faste stoffer: Disse forbindelser dannes af den elektrostatiske tiltrækning mellem positivt ladede metalkationer (m⁺, m²⁺ osv.) Og negativt ladede ikke-metalanioner (i dette tilfælde s²⁻).
* afbalanceringsligninger: Målet er at sikre, at antallet af atomer i hvert element er det samme på begge sider af ligningen.
Generel reaktion:
Metal (M) + svovl (er) → Metalsulfid (MS)
specifikke eksempler
1. natrium (NA) og svovl (er)
* ubalanceret: Na + S → Na₂s
* afbalanceret: 2NA + S → NA₂S
2. magnesium (mg) og svovl (r)
* ubalanceret: Mg + S → MGS
* afbalanceret: Mg + S → MGS
3. aluminium (AL) og svovl (er)
* ubalanceret: Al + S → Al₂s₃
* afbalanceret: 2al + 3s → Al₂s₃
4. jern (Fe) og svovl (er)
* ubalanceret: Fe + S → FES
* afbalanceret: Fe + S → FES
Nøglepunkter
* Forudsigelse af gebyrer: Du skal kende de almindelige ladninger af metalioner for at bestemme den korrekte formel for metalsulfidet. For eksempel danner natrium (Na) Na⁺, magnesium (Mg) mg²⁺ og aluminium (AL) danner al³⁺.
* afbalancering ved inspektion: Start med at afbalancere metalatomerne, og afbalancere derefter svovlatomerne. Det kan være nødvendigt at justere koefficienter foran reaktanterne og produkterne, indtil ligningen er afbalanceret.
Fortæl mig, hvis du gerne vil have mig til at skrive afbalancerede ligninger til andre metaller!
 Varme artikler
Varme artikler
-
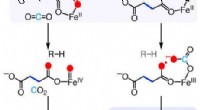 Vejen til fremstilling af ethylenMekanismer for de ethylen-dannende enzym (EFE) reaktioner. Ny forskning beskriver de kemiske trin, som dette naturligt forekommende enzym bruger til at omdanne en almindelig kemisk forbindelse til eth
Vejen til fremstilling af ethylenMekanismer for de ethylen-dannende enzym (EFE) reaktioner. Ny forskning beskriver de kemiske trin, som dette naturligt forekommende enzym bruger til at omdanne en almindelig kemisk forbindelse til eth -
 Ingeniører finder, at flaskebørste -copolymerer kan skræddersys til applikationerRice University kandidatstuderende Hao Mei holder en tallerken med et mønster af flaskebørstepolymerer stavning RICE. De mikroskopiske polymerer kunne give industrien udsøgt kontrol over overfladebelæ
Ingeniører finder, at flaskebørste -copolymerer kan skræddersys til applikationerRice University kandidatstuderende Hao Mei holder en tallerken med et mønster af flaskebørstepolymerer stavning RICE. De mikroskopiske polymerer kunne give industrien udsøgt kontrol over overfladebelæ -
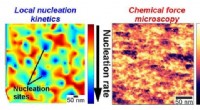 Kortlægning af nukleationskinetik med nanometeropløsningKredit:Mei Wang, University of Maryland Nukleering er dannelsen af en ny kondenseret fase fra en flydende fase via selvsamling. Denne proces er afgørende for mange naturlige systemer og tekniske
Kortlægning af nukleationskinetik med nanometeropløsningKredit:Mei Wang, University of Maryland Nukleering er dannelsen af en ny kondenseret fase fra en flydende fase via selvsamling. Denne proces er afgørende for mange naturlige systemer og tekniske -
 Todimensionel MXene som et nyt elektrodemateriale til næste generations displayKredit:CC0 Public Domain Forskere i USA og Korea rapporterede de første effektive fleksible lysemitterende dioder med en todimensionel titaniumcarbid MXene som en fleksibel og gennemsigtig elektro
Todimensionel MXene som et nyt elektrodemateriale til næste generations displayKredit:CC0 Public Domain Forskere i USA og Korea rapporterede de første effektive fleksible lysemitterende dioder med en todimensionel titaniumcarbid MXene som en fleksibel og gennemsigtig elektro
- High-fidelity-registrering af Jordens klimahistorie sætter aktuelle ændringer i kontekst
- Hvad er den største æra, og hvor stor en procentdel af jordens historie udgør den?
- Klimakrisen er kommet - så stop med at føle skyld og begynd at forestille dig din fremtid
- Nanokanalelektroporation:Forskere foretager præcis genterapi uden en nål
- Hera-missionens utrolige eventyr
- Demokratier mere tilbøjelige til at starte krige - undtagen når de ikke er det


