Er kuldioxid og tetrachlorid de eneste to ikke -polære molekyler?
* ikke -polære molekyler er molekyler, hvor elektronerne distribueres jævnt i hele molekylet. Dette resulterer i intet samlet dipolmoment (en adskillelse af positiv og negativ ladning).
Her er nogle eksempler på ikke -polære molekyler:
* diatomiske molekyler: Disse består af to atomer af det samme element, såsom:
* H₂ (brint)
* O₂ (ilt)
* N₂ (nitrogen)
* F₂ (fluor)
* Cl₂ (klor)
* Br₂ (Brom)
* I₂ (iod)
* symmetriske molekyler: Disse har en afbalanceret fordeling af atomer og bindinger, selvom de indeholder polære bindinger (bindinger mellem atomer med forskellig elektronegativitet). For eksempel:
* Ch₄ (metan)
* Bf₃ (bortrifluorid)
* CO₂ (kuldioxid)
* Ccl₄ (tetrachlormethan)
* SF₆ (svovl hexafluorid)
Vigtig note: Hvorvidt et molekyle er polært eller ikke -polært afhænger af dens form og de typer bindinger, den indeholder. Tommelfingerreglen er: Hvis et molekyle har en symmetrisk form, og alle bindinger er ikke -polære, vil det være ikke -polært.
Fortæl mig, hvis du gerne vil udforske specifikke eksempler mere detaljeret!
Sidste artikelHvor mange molekyler er til stede i 2C6H12O6?
Næste artikelHvad er formlen for Mercury1 -nitrat?
 Varme artikler
Varme artikler
-
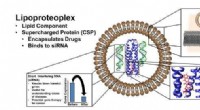 Forskere skaber biomateriale, der leverer både et kraftfuldt lægemiddel og gendæmpereLipoproteoplex bruger en lipid-beholder til transfektion - transport af materiale forbi en cellemembran - og en proteinkapsel, der er nem at fremstille, der kan binde både små molekyle kemoterapeutisk
Forskere skaber biomateriale, der leverer både et kraftfuldt lægemiddel og gendæmpereLipoproteoplex bruger en lipid-beholder til transfektion - transport af materiale forbi en cellemembran - og en proteinkapsel, der er nem at fremstille, der kan binde både små molekyle kemoterapeutisk -
 Åndeanalysator i skoæskestørrelse opdager dødelig lungesygdom hurtigere, mere præcist end læge…Ser man ind i det beskyttende betræk af en bærbar åndedrætsmonitor udviklet af University of Michigan, der hurtigt og præcist kan detektere akut respiratorisk distress syndrome (ARDS) i den kritiske a
Åndeanalysator i skoæskestørrelse opdager dødelig lungesygdom hurtigere, mere præcist end læge…Ser man ind i det beskyttende betræk af en bærbar åndedrætsmonitor udviklet af University of Michigan, der hurtigt og præcist kan detektere akut respiratorisk distress syndrome (ARDS) i den kritiske a -
 Kemikere opnår gennembrud i produktionen af tredimensionelle molekylære strukturerKemikere bruger denne eksperimentelle opsætning til fotokemiske reaktioner. Kredit:Peter Bellotti Et vigtigt mål for organisk og medicinsk kemi i de seneste årtier har været den hurtige syntese af
Kemikere opnår gennembrud i produktionen af tredimensionelle molekylære strukturerKemikere bruger denne eksperimentelle opsætning til fotokemiske reaktioner. Kredit:Peter Bellotti Et vigtigt mål for organisk og medicinsk kemi i de seneste årtier har været den hurtige syntese af -
 Kemikere udvikler en bioinspireret strategi til kontrolleret syntese af polyenerLysdrevet flip af alkengeometri. Kredit:Ryan Gilmour De forekommer i naturen, er reaktive og spiller en rolle i mange biologiske processer:polyener. Det er ikke underligt, at kemikere i lang tid h
Kemikere udvikler en bioinspireret strategi til kontrolleret syntese af polyenerLysdrevet flip af alkengeometri. Kredit:Ryan Gilmour De forekommer i naturen, er reaktive og spiller en rolle i mange biologiske processer:polyener. Det er ikke underligt, at kemikere i lang tid h
- Rumstationens besætning lægger til ved ISS efter virus-ramt opbygning
- Den første brug af vejrudsigter til at vise menneskelig indvirkning på ekstreme er 'forvandlende',…
- Kan en standby-etiket reducere strømforbruget?
- Er matteret glas en god varmeleder?
- New Zealand lancerer plan for at genoplive sundheden i søer og floder
- Det er måske ikke HQ2, men AOC erklærer sejr og troller Amazon over New York-udvidelsen


