Hvad er forbrænding af sølvoxid?
Mens sølvoxid indeholder ilt, er det allerede i en oxideret tilstand. Det reagerer ikke let med mere ilt for at producere yderligere oxidation. I stedet nedbrydes sølvoxid, når den opvarmes:
2ag₂o (s) → 4Ag (s) + O₂ (g)
Denne reaktion er ikke forbrænding , men snarere en termisk nedbrydning . Når det opvarmes, bryder sølvoxid ned i metallisk sølv og iltgas.
Her er grunden til, at sølvoxid ikke forbrænder:
* det er allerede oxideret: Sølvoxid er et produkt af oxidation, ikke en brændstofkilde.
* nedbrydning, ikke oxidation: Opvarmning af sølvoxid får det til at nedbrydes i dets elementære komponenter i stedet for at reagere med ilt.
Kortfattet: Mens sølvoxid er en forbindelse, der indeholder ilt, gennemgår det ikke forbrænding. Det nedbrydes, når den opvarmes til sølv- og iltgas.
 Varme artikler
Varme artikler
-
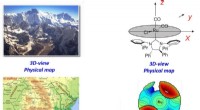 Kortlægning af den tredimensionelle struktur af katalytiske centre hjælper med at designe nye og f…3D -strukturen af landskabsbilledet (øverst til venstre) kan sammenlignes med 3D -billedet af katalysatoren (øverst til højre). Tilsvarende det geografiske kort (nederst til venstre) kan sammenligne
Kortlægning af den tredimensionelle struktur af katalytiske centre hjælper med at designe nye og f…3D -strukturen af landskabsbilledet (øverst til venstre) kan sammenlignes med 3D -billedet af katalysatoren (øverst til højre). Tilsvarende det geografiske kort (nederst til venstre) kan sammenligne -
 Kemikere gør hård plast genanvendeligKredit:Unsplash/CC0 Public Domain Termosæt, som omfatter epoxy, polyurethaner, og gummi brugt til dæk, findes i mange produkter, der skal være holdbare og varmebestandige, såsom biler eller elektr
Kemikere gør hård plast genanvendeligKredit:Unsplash/CC0 Public Domain Termosæt, som omfatter epoxy, polyurethaner, og gummi brugt til dæk, findes i mange produkter, der skal være holdbare og varmebestandige, såsom biler eller elektr -
 Forskere opdrætter bakterier, der laver små højenergi-carbonringeEn kunstners skildring af et bakterielt enzym og den højenergiske kulstofring, det skabte. Kredit:Caltech Caltech-forskere har skabt en bakteriestamme, der kan lave små, men energipakkede carbonri
Forskere opdrætter bakterier, der laver små højenergi-carbonringeEn kunstners skildring af et bakterielt enzym og den højenergiske kulstofring, det skabte. Kredit:Caltech Caltech-forskere har skabt en bakteriestamme, der kan lave små, men energipakkede carbonri -
 Nye molekyler afledt af cannabidiol er designet med mere potente antioxidanterImmunologi professor Eduardo Muñoz. Kredit:University of Córdoba I dag, cannabidiol er en stjernekomponent, ikke kun i kosmetikkens verden, men også inden for medicin og ernæring på grund af dets
Nye molekyler afledt af cannabidiol er designet med mere potente antioxidanterImmunologi professor Eduardo Muñoz. Kredit:University of Córdoba I dag, cannabidiol er en stjernekomponent, ikke kun i kosmetikkens verden, men også inden for medicin og ernæring på grund af dets
- Hvordan diabetes virker
- Proteolytisk enzym, der udskilles som proenzym i GI-traktat-hvorfor?
- Vulkanudbruddet i Ilopango, der chokerede Maya-civilisationen for 1590 år siden
- Forskning slår puslespil om, hvorfor humlebien kan flyve så godt
- Flytte diagnostik ud af laboratoriet og ind i din hånd
- STEM:Bestræbelser på at inspirere flere børn kunne forankre uddannelsesmæssige uligheder


