Hvordan reagerer en syre med carbonater?
Kemien:
* syrer Slip hydrogenioner (H+) i opløsning.
* carbonater indeholder carbonation (co₃²⁻).
Når en syre og et carbonat blandes, reageres hydrogenioner fra syren med carbonationerne. Denne reaktion producerer kulsyre (H₂CO₃), som er ustabil og nedbrydes hurtigt til kuldioxid og vand:
H⁺ + co₃²⁻ → H₂co₃ → CO₂ + H₂O
Eksempelreaktion:
Lad os tage eksemplet på saltsyre (HCI), der reagerer med natriumcarbonat (Na₂co₃):
2HCI (aq) + na₂co₃ (aq) → 2naCl (aq) + co₂ (g) + h₂o (l)
Forklaring:
* hcl (saltsyre) tilvejebringer hydrogenioner (H+).
* na₂co₃ (natriumcarbonat) tilvejebringer carbonationer (co₃²⁻).
* naCl (natriumchlorid) er det salt dannet.
* co₂ (Kuldioxid) frigøres som en gas.
* h₂o (vand) produceres også.
Nøgleobservationer:
* fizzing: Du vil ofte observere fizzing eller boblende, når kuldioxidgas frigøres.
* Ændring i temperatur: Reaktionen kan være eksoterm (frigivelse af varme) eller endotermisk (absorberende varme) afhængigt af den specifikke syre og carbonat.
Ansøgninger:
* bagning: Denne reaktion bruges til bagning til at producere kuldioxidgas, hvilket får kager og brød til at stige.
* antacida: Antacida indeholdende carbonater neutraliserer mavesyre og producerer kuldioxid.
* rengøring: Carbonater bruges i nogle rengøringsprodukter til at fjerne snavs og fedt, ofte ved hjælp af sure midler.
 Varme artikler
Varme artikler
-
 Forskning afdækker potentiel bæredygtig raffineringsmetode for ligninKredit:CC0 Public Domain Lignin, bruges som en vedvarende ressource til at producere produkter af høj værdi, har givet både produktionsmæssige og økonomiske udfordringer for bioraffinaderidriften.
Forskning afdækker potentiel bæredygtig raffineringsmetode for ligninKredit:CC0 Public Domain Lignin, bruges som en vedvarende ressource til at producere produkter af høj værdi, har givet både produktionsmæssige og økonomiske udfordringer for bioraffinaderidriften. -
 Et nyt anti-anfaldsmål?Kredit:CC0 Public Domain Temporallapsepilepsi (TLE) er den mest almindelige form for epilepsi med fokale anfald, og omkring en tredjedel af personer med TLE oplever anfald, der ikke reagerer på me
Et nyt anti-anfaldsmål?Kredit:CC0 Public Domain Temporallapsepilepsi (TLE) er den mest almindelige form for epilepsi med fokale anfald, og omkring en tredjedel af personer med TLE oplever anfald, der ikke reagerer på me -
 Det værdifulde bidrag fra stress til den termiske stabilitet af nanokornede polykrystallinske leger…Kredit:CC0 Public Domain Nanokornede metaller og legeringer, hvis kornstørrelse er mindre end 100 nm, udviser ekstrem høj styrke og høj duktilitet, har fremragende mekaniske egenskaber. Nanokorned
Det værdifulde bidrag fra stress til den termiske stabilitet af nanokornede polykrystallinske leger…Kredit:CC0 Public Domain Nanokornede metaller og legeringer, hvis kornstørrelse er mindre end 100 nm, udviser ekstrem høj styrke og høj duktilitet, har fremragende mekaniske egenskaber. Nanokorned -
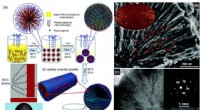 Hierarkisk mesoporøse titaniumdioxidmaterialer til energi- og miljøanvendelserSkematisk fremstilling af dannelsesprocessen for hierarkisk mesoporøse TiO2-mikrosfærer med enkeltkrystallignende porevæg gennem fordampningsdrevet orienteret samling (a). SEM-billede af en enkelt ult
Hierarkisk mesoporøse titaniumdioxidmaterialer til energi- og miljøanvendelserSkematisk fremstilling af dannelsesprocessen for hierarkisk mesoporøse TiO2-mikrosfærer med enkeltkrystallignende porevæg gennem fordampningsdrevet orienteret samling (a). SEM-billede af en enkelt ult


