Hvilken binding eller interaktion ville være vanskelig at forstyrre, når forbindelser sættes i vand?
* kovalente obligationer Involver deling af elektroner mellem atomer. Disse obligationer er meget stærke og kræver en betydelig mængde energi for at bryde.
* vand er et polært opløsningsmiddel, hvilket betyder, at det har en positiv og negativ ende. Denne polaritet giver den mulighed for at opløse mange ioniske forbindelser og nogle polære kovalente forbindelser ved at interagere med deres ladninger.
* ioniske bindinger dannes af den elektrostatiske tiltrækning mellem modsat ladede ioner. Mens disse bindinger er stærke, kan de forstyrres af vandmolekyler, fordi de positive og negative ender af vand kan interagere med ionerne, hvilket svækker den ioniske binding.
* Hydrogenbindinger er en type dipol-dipolinteraktion, der forekommer mellem et hydrogenatom kovalent knyttet til et stærkt elektronegativt atom (som ilt eller nitrogen) og et elektronpar i det tilstødende molekyle. Disse er relativt svage obligationer, men spiller en betydelig rolle i vandets egenskaber.
Kortfattet: Mens vand kan forstyrre ioniske og brintbindinger, har det generelt ikke nok energi til at bryde de stærke kovalente bindinger inden for molekyler.
Eksempel: Overvej bordsalt (NaCl). Den ioniske binding mellem natrium (Na+) og chlorid (CL-) forstyrres, når de opløses i vand. Imidlertid forbliver den kovalente binding inden for vandmolekylet (H2O) intakt.
 Varme artikler
Varme artikler
-
 Lysdrevne nano-organismer forbruger CO2, skabe miljøvenlig plast og brændstofUniversity of Colorado Boulder Adjunkt Prashant Nagpal Kredit:Casey A. Cass University of Colorado Boulder forskere har udviklet nanobio-hybride organismer, der er i stand til at bruge luftbåren k
Lysdrevne nano-organismer forbruger CO2, skabe miljøvenlig plast og brændstofUniversity of Colorado Boulder Adjunkt Prashant Nagpal Kredit:Casey A. Cass University of Colorado Boulder forskere har udviklet nanobio-hybride organismer, der er i stand til at bruge luftbåren k -
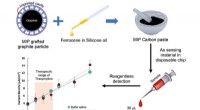 Ny grafitbaseret hurtig sensorchip til teofyllinovervågning i realtidForskere fra SIT, Japan, har designet en billig sensorchip med grafitbaseret molekylært præget polymer som elektrode. Denne chip kan bruges til at detektere og overvåge theophyllin niveauer. Kredit:Ya
Ny grafitbaseret hurtig sensorchip til teofyllinovervågning i realtidForskere fra SIT, Japan, har designet en billig sensorchip med grafitbaseret molekylært præget polymer som elektrode. Denne chip kan bruges til at detektere og overvåge theophyllin niveauer. Kredit:Ya -
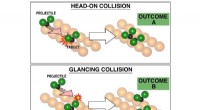 Kemikere fremmer evnen til at kontrollere kemiske reaktionerValget af påvirkningsparameteren er grundlæggende for resultatet af kemisk reaktion, som visualiseret her baseret på eksperimenter. Ved nul indvirkningsparameter, reaktionen øverst viste reproducerbar
Kemikere fremmer evnen til at kontrollere kemiske reaktionerValget af påvirkningsparameteren er grundlæggende for resultatet af kemisk reaktion, som visualiseret her baseret på eksperimenter. Ved nul indvirkningsparameter, reaktionen øverst viste reproducerbar -
 Nyt avanceret materiale viser ekstraordinær stabilitet over et bredt temperaturområdeForskere fra UNSW har fundet et ekstraordinært materiale, der ikke udvider sig eller trækker sig sammen over et ekstremt bredt temperaturområde og kan være et af de mest stabile materialer, man kender
Nyt avanceret materiale viser ekstraordinær stabilitet over et bredt temperaturområdeForskere fra UNSW har fundet et ekstraordinært materiale, der ikke udvider sig eller trækker sig sammen over et ekstremt bredt temperaturområde og kan være et af de mest stabile materialer, man kender
- hugget i sten? At omdanne kuldioxid til sten, for altid
- Adskillelsen af alleler kaldes?
- Hideo Kojima:gådefuld spilskaber inspireret af film
- Hvad tid for lys at rejse sol jord?
- Hvordan påvirker en planeter afstand fra solen sin orbithastighed?
- EU-bilproducenter puster emissionerne op for at skæve kulstofmålene


