Hvorfor ekstrakt opvarmning med kulstofkobber fra oxid?
Kemien:
* kobberoxid (CUO) er en forbindelse, hvor kobber har en positiv ladning (+2).
* carbon (c) er et godt reduktionsmiddel, hvilket betyder, at det let mister elektroner.
* Når det opvarmes, reagerer kulstof med kobberoxid og tager ilt fra oxidet. Dette danner kuldioxid (CO2) .
* Kobberet, nu uden ilt, reduceres tilbage til sin elementære form (Cu).
Reaktionsligning:
2CUO + C → 2CU + CO2
Hvorfor det fungerer:
* Carbon's tilknytning til ilt: Carbon har en høj affinitet for ilt og danner let kuldioxid.
* termodynamik: Reaktionen er termodynamisk gunstig, hvilket betyder, at den frigiver energi og fortsætter spontant ved høje temperaturer.
i enklere termer:
Forestil dig kulstof som en "tyv", der "stjæler" ilt fra kobberoxid. Dette efterlader kobberet i sin rene form. Varmen giver energien til, at reaktionen kan forekomme.
Praktiske applikationer:
Denne reaktion bruges i den industrielle ekstraktion af kobber fra dens malm. Kulstofkilden kan være koks eller trækul, og reaktionen finder sted i en ovn ved høje temperaturer.
Vigtig note: Dette er en forenklet forklaring. Den faktiske proces med kobberekstraktion er mere kompleks og involverer flere stadier. Imidlertid forbliver det grundlæggende princip om anvendelse af kulstof som et reduktionsmiddel til at ekstrahere kobber fra dets oxid det samme.
Sidste artikelHvad er 10 fakta om fluor?
Næste artikelHvor mange mol jern er til stede i 3,15e24 atomer jern?
 Varme artikler
Varme artikler
-
 Tæmning af defekter i nanoporøse materialer for at udnytte dem godtÆndring af defekte nanoporøse materialer har unikke effekter på deres egenskaber. Swansea University-forskere søger at mestre denne metode til at lave nye materialer til at opfange CO2. Kredit:Swansea
Tæmning af defekter i nanoporøse materialer for at udnytte dem godtÆndring af defekte nanoporøse materialer har unikke effekter på deres egenskaber. Swansea University-forskere søger at mestre denne metode til at lave nye materialer til at opfange CO2. Kredit:Swansea -
 At bringe MOF'er ind i det industrielle lysScanningelektronmikroskopibillede af et MOF -glas. Kredit:Shane Telfer, MacDiarmid Institute for Advanced Materials and Nanotechnology, Institut for Grundvidenskab, Massey Universitet, New Zealand
At bringe MOF'er ind i det industrielle lysScanningelektronmikroskopibillede af et MOF -glas. Kredit:Shane Telfer, MacDiarmid Institute for Advanced Materials and Nanotechnology, Institut for Grundvidenskab, Massey Universitet, New Zealand -
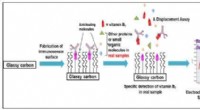 B7 -vitaminovervågningsenhed til analyse af fødevarer og kliniske prøverUdvikling af en elektrokemisk immunosensor til direkte påvisning af vitamin B7 i rigtige prøver. Kredit:Dr. Khor Sook Mei Direkte påvisning af vitamin B7 i ægte prøve er mulig ved hjælp af den udv
B7 -vitaminovervågningsenhed til analyse af fødevarer og kliniske prøverUdvikling af en elektrokemisk immunosensor til direkte påvisning af vitamin B7 i rigtige prøver. Kredit:Dr. Khor Sook Mei Direkte påvisning af vitamin B7 i ægte prøve er mulig ved hjælp af den udv -
 Sous vide tilberedningsmetode gør oksekødsprotein mere fordøjeligtKredit:American Chemical Society Engang brugt til at tilberede køkken på kun de fineste restauranter, sous vide er nu på vej ind i hjemmekokernes køkkener. Fransk for under vakuum, Teknikken indeb
Sous vide tilberedningsmetode gør oksekødsprotein mere fordøjeligtKredit:American Chemical Society Engang brugt til at tilberede køkken på kun de fineste restauranter, sous vide er nu på vej ind i hjemmekokernes køkkener. Fransk for under vakuum, Teknikken indeb
- Sort hul eller nyfødte stjerner? SOFIA finder galaktisk puslespil
- En ny art af mørkebillelarver, der nedbryder plastik
- Astronomidata og søgen efter beboelige verdener
- Kontaktløs 3-D fingeraftryksidentifikation
- Når vand og ammoniumnitrat blandes, falder temperaturen. hvilken type reaktion er det hvorfor?
- Udvikling af holdbar MTJ under barske omgivelser til STT-MRAM ved 1Xnm teknologiknude


