Hvilken opløsning er form ved at opløse ammoniakgas i methylbenzen?
* opløselighed: Ammoniak er et polært molekyle på grund af dets nitrogen-hydrogenbindinger og dets ensomme par elektroner. Det er meget opløseligt i polære opløsningsmidler som vand. Methylbenzen er på den anden side et ikke -polært molekyle. Ligesom opløser som, hvilket betyder, at polære stoffer opløses godt i andre polære stoffer, og ikke -polære stoffer opløses godt i andre ikke -polære stoffer.
* interaktion: Der er meget lidt interaktion mellem de polære ammoniakmolekyler og de ikke -polære methylbenzenmolekyler. De svage van der Waals -styrker mellem dem er utilstrækkelige til at overvinde den stærke hydrogenbinding i ammoniak.
Hvad kan der ske:
* minimal opløselighed: Du kan se en meget lille mængde ammoniak opløses i methylbenzen, men det ville være ubetydelig.
* to lag: Mere sandsynligt ville ammoniakgassen simpelthen boble gennem methylbenzenen og danne to separate lag.
Vigtig note: Mens en løsning er usandsynlig, er det muligt, at en reaktion kan forekomme, hvis andre tilstande er til stede (som en katalysator eller højt tryk). Uden yderligere information forventes der imidlertid ikke en løsningsdannelse.
Sidste artikelHvordan er kogningen af vand og køledamp en reversibel reaktion?
Næste artikelHvad producerer ATP NADH og CO2?
 Varme artikler
Varme artikler
-
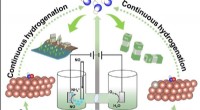 Fremme nitrogenoxidelektroreduktion til ammoniak over elektronrigt Cu moduleret af Ru-dopingSkematisk illustration til at fremme nitrogenoxidelektroreduktion til ammoniak over ved Ru-doping. Kredit:Science China Press Som et vigtigt nitrogenholdigt kemikalie, ammoniak spiller en afgørend
Fremme nitrogenoxidelektroreduktion til ammoniak over elektronrigt Cu moduleret af Ru-dopingSkematisk illustration til at fremme nitrogenoxidelektroreduktion til ammoniak over ved Ru-doping. Kredit:Science China Press Som et vigtigt nitrogenholdigt kemikalie, ammoniak spiller en afgørend -
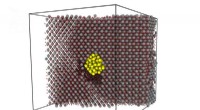 Forskere finder forklaring på unormalt hurtig frigivelse af gas fra atombrændstofEksempel på en beregningscelle:et krystalgitter af urandioxid (grå atomer er uran, røde atomer - ilt) indeholdende en boble af xenon (gule atomer). Uranatomer forskudt til inter-nodale positioner er v
Forskere finder forklaring på unormalt hurtig frigivelse af gas fra atombrændstofEksempel på en beregningscelle:et krystalgitter af urandioxid (grå atomer er uran, røde atomer - ilt) indeholdende en boble af xenon (gule atomer). Uranatomer forskudt til inter-nodale positioner er v -
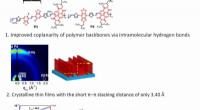 Organisk elektronik:Forskere udvikler en højtydende unipolær n-type tyndfilmstransistorRationelt design af elektrontransporterende organiske halvledende polymerer og deres tyndfilmsanalyse og transistorpræstationer. Kredit: Journal of the American Chemical Society Forskere ved Toky
Organisk elektronik:Forskere udvikler en højtydende unipolær n-type tyndfilmstransistorRationelt design af elektrontransporterende organiske halvledende polymerer og deres tyndfilmsanalyse og transistorpræstationer. Kredit: Journal of the American Chemical Society Forskere ved Toky -
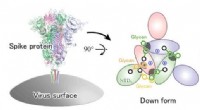 Glykaner er afgørende for COVID-19-infektionMolekylær mekanisme, der ligger til grund for den strukturelle ændring af SARS-CoV-2 spike-proteinet. Kredit:RIKEN En forskergruppe ved RIKEN Center for Computational Science (R-CCS) har fundet ud
Glykaner er afgørende for COVID-19-infektionMolekylær mekanisme, der ligger til grund for den strukturelle ændring af SARS-CoV-2 spike-proteinet. Kredit:RIKEN En forskergruppe ved RIKEN Center for Computational Science (R-CCS) har fundet ud
- Forskere foreslår løsninger til dilemma for urinprøver
- Sådan beregnes midtpunktet mellem to tal
- Almindelige mikrober slår sig sammen for at nedbryde polymerkompositter
- Hvem får mest ud af højtuddannede udenlandske arbejdere?
- Sådan konverteres en generator til en generator
- 87 neandertaler-fodspor fundet på en gammel iberisk kystlinje


