Hvilken er mest reaktiv ethyne eller benzen?
Her er hvorfor:
* Ethyne har en tredobbelt obligation: Carbon-carbon-triplebindingen i ethyne er meget reaktiv på grund af den høje elektrondensitet og tilstedeværelsen af PI-bindinger. Denne tredobbelte binding gør ethyne modtagelig for elektrofilt angreb, hvilket fører til tilsætningsreaktioner.
* benzen har et delokaliseret PI -system: Benzen har et stabilt, delokaliseret PI -elektronsystem, der gør det mindre reaktivt end ethyne. Denne elektron -delokalisering hjælper med at stabilisere molekylet og gør det mindre modtageligt for angreb fra elektrofiler.
Sammenligning af reaktivitet:
* ethyne: Reagerer let med halogener, brinthalogenider og vand til dannelse af tilsætninger. Det bruges også i forbrændingsreaktioner til at producere en varm flamme.
* benzen: Kræver specifikke betingelser (f.eks. Katalysatorer og høje temperaturer) for at gennemgå elektrofile aromatiske substitutionsreaktioner. Det er relativt ureaktivt over for de mest almindelige reagenser.
Kortfattet: Ethynes tredobbelte binding og mangel på aromatisk stabilisering gør det markant mere reaktivt end benzen.
Sidste artikelHvad er virkningerne af klor på kobber?
Næste artikelHvad er de to vigtigste gasser, der udgør luft?
 Varme artikler
Varme artikler
-
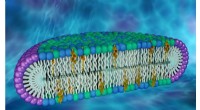 Ny cellemembranmodel kan være nøglen til at afdække nye proteinegenskaberForskere brugte neutron- og røntgenspredningsteknikker ved Oak Ridge og Brookhaven National Laboratories til at karakterisere skiveformede strukturer, kendt som biceller, der efterligner cellemembrane
Ny cellemembranmodel kan være nøglen til at afdække nye proteinegenskaberForskere brugte neutron- og røntgenspredningsteknikker ved Oak Ridge og Brookhaven National Laboratories til at karakterisere skiveformede strukturer, kendt som biceller, der efterligner cellemembrane -
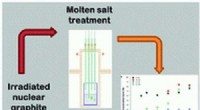 Ny behandlingsteknologi kan reducere UK nukleart affaldsbyrdeKredit:DOI:10.1039/D1EE00332A Forskere ved University of Manchester har udviklet en ny behandlingsteknologi, der kan hjælpe med at reducere Storbritanniens atomaffaldsbyrde markant. Håndteringen
Ny behandlingsteknologi kan reducere UK nukleart affaldsbyrdeKredit:DOI:10.1039/D1EE00332A Forskere ved University of Manchester har udviklet en ny behandlingsteknologi, der kan hjælpe med at reducere Storbritanniens atomaffaldsbyrde markant. Håndteringen -
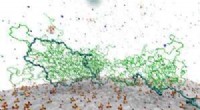 Et hårdt kig på polymerer i cementblandingComputermodeller har afdækket, hvordan superplastikere adsorberes på overfladen af cementpartikler. Kredit:Gengivet fra Ref. 1 og licenseret under CC BY 4.0 2018 T. Hirata et al. Modellering af,
Et hårdt kig på polymerer i cementblandingComputermodeller har afdækket, hvordan superplastikere adsorberes på overfladen af cementpartikler. Kredit:Gengivet fra Ref. 1 og licenseret under CC BY 4.0 2018 T. Hirata et al. Modellering af, -
 En enklere model kommer til sagen med proteinerCecilia Clementi. Kredit:Jeff Fitlow/Rice University Beregningsmodeller er kommet langt i deres evne til at simulere de mest basale biologiske processer, såsom hvordan proteiner folder. En ny tekn
En enklere model kommer til sagen med proteinerCecilia Clementi. Kredit:Jeff Fitlow/Rice University Beregningsmodeller er kommet langt i deres evne til at simulere de mest basale biologiske processer, såsom hvordan proteiner folder. En ny tekn
- Forskere opdager, hvordan NMDAR-proteinet udfører en 'Twist'-lignende dansebevægelse
- Hvad ville være sandt for værdierne for begyndelseshastighed og slut, hvis accelerationen var nul?…
- Hvordan vil klimaændringer påvirke dit levebrød?
- Hvordan dannes maldivisk jord?
- Bekæmpelse af brande, før de gnister
- Den højeste præ-moderne blyforurening fandt sted for 800 år siden


