Hvad ville der ske med koncentrationen af hydrogenioner i en opløsning stærk syre, hvis der blev tilsat et lige antal hydroxidopløsning?
Hydrogenionkoncentrationen ville falde.
Forklaring:
* Stærke syrer: Stærke syrer ioniserer fuldstændigt i opløsningen, hvilket betyder, at de frigiver alle deres hydrogenioner (H+) i opløsningen.
* Hydroxidioner: Hydroxidioner (OH-) er basiskomponenten i vand. De er stærke baser.
* neutralisering: Når en stærk syre og en stærk base reagerer, neutraliserer de hinanden. Dette betyder, at hydrogenionerne (H+) fra syren reagerer med hydroxidionerne (OH-) fra basen til dannelse af vand (H2O).
reaktion:
H + (fra syre) + OH- (fra base) → H2O
Resultat:
* Tilsætningen af hydroxidioner forbruger direkte hydrogenioner i opløsningen, hvilket reducerer deres koncentration.
* Da syren og basen reagerer i et forhold på 1:1, hvis du tilsætter et lige antal hydroxidioner til brintioner, vil opløsningen blive neutral.
* Hvis du tilsætter flere hydroxidioner end hydrogenioner, vil opløsningen blive grundlæggende.
Vigtig note: Den endelige pH i opløsningen afhænger af den indledende koncentration af den stærke syre og mængden af hydroxidioner tilsat.
 Varme artikler
Varme artikler
-
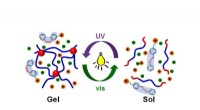 Fotoreversibel molekylær switch ændrer den fysiske egenskab af termoresponsiv polymerSkematisk illustration af sol-gelovergang udløst af fotoisomerisering af azobenezen-holdig ionisk flydende molekylær switch. Kredit:Yokohama National University Forskere har udviklet en ny strateg
Fotoreversibel molekylær switch ændrer den fysiske egenskab af termoresponsiv polymerSkematisk illustration af sol-gelovergang udløst af fotoisomerisering af azobenezen-holdig ionisk flydende molekylær switch. Kredit:Yokohama National University Forskere har udviklet en ny strateg -
 MR -mærker klæber til molekyler med kemisk velcroI den nye teknik, MR -kemiske mærker knytter sig til et målmolekyle og intet andet - ligesom hvordan velcro kun klæber til sig selv. Kredit:tanakawho, via Flickr Forestil dig at vedhæfte et fyrtår
MR -mærker klæber til molekyler med kemisk velcroI den nye teknik, MR -kemiske mærker knytter sig til et målmolekyle og intet andet - ligesom hvordan velcro kun klæber til sig selv. Kredit:tanakawho, via Flickr Forestil dig at vedhæfte et fyrtår -
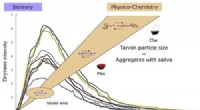 Hvorfor nogle rødvine smager tørtKredit:American Chemical Society Vinkendere kan nemt skelne mellem en tør rødvin, såsom Cabernet Sauvignon, fra en mere frugtbar rød, ligesom Pinot Noir. Forskere har længe forbundet følelsen af
Hvorfor nogle rødvine smager tørtKredit:American Chemical Society Vinkendere kan nemt skelne mellem en tør rødvin, såsom Cabernet Sauvignon, fra en mere frugtbar rød, ligesom Pinot Noir. Forskere har længe forbundet følelsen af -
 COVID-19 antistoftest:Hvor pålidelige er de?Kredit:CC0 Public Domain Med hjemmeværende ordrer, der udløber rundt om i verden, mange håber, at COVID-19 antistoftestning vil hjælpe virksomheder og institutioner med at genåbne sikkert. At afgø
COVID-19 antistoftest:Hvor pålidelige er de?Kredit:CC0 Public Domain Med hjemmeværende ordrer, der udløber rundt om i verden, mange håber, at COVID-19 antistoftestning vil hjælpe virksomheder og institutioner med at genåbne sikkert. At afgø
- Hvilket af følgende er et målmaterialer evne til at transmittere væsker gennem sammenkoblede pore…
- Hvilke planter er de grådige?
- NASA vil styrte et rumfartøj ind i en 525 fod bred asteroide i september. Sådan ser du det
- Hvor kommer vandet fra i dehydreringssyntese?
- Flow kemi teknik tilbyder hurtigere, sikrere måde at skærme på, studere og optimere industrielle …
- Jeg har 150 ml, hvor mange i liter har jeg?


