Hvilke 2 fysiske egenskaber kan bruges til at adskille ethanol og vand?
1. kogepunkt: Ethanol har et lavere kogepunkt (78,37 ° C) end vand (100 ° C). Denne forskel giver mulighed for destillation , hvor blandingen opvarmes til en temperatur mellem de to kogepunkter. Ethanolen fordampes først, opsamles og kondenseres derefter tilbage i flydende ethanol, hvilket efterlader vandet.
2. densitet: Vand er tættere end ethanol. Denne forskel kan bruges til væske-væske-ekstraktion . Et opløsningsmiddel, der er ikke -blandbart med vand og har en større affinitet for ethanol (som diethylether), kan tilsættes til blandingen. Ethanolen opløses fortrinsvis i opløsningsmidlet og skaber to forskellige lag. Lagene kan derefter adskilles, og ethanolen kan udvindes fra opløsningsmiddellaget.
Sidste artikelHar brom en større værdi for ionisk radius end fluor?
Næste artikelEr opløsning af ammoniak i vandsyrer?
 Varme artikler
Varme artikler
-
 Test af designet kulstofmaterialer til at rense spildevandKredit:CC0 Public Domain Affaldsstrømme fra industri og landbrug kunne bruges til produktion af kul, der kan tjene som en billig adsorbent til vandrensning. I sit speciale på Industridoktoralskole
Test af designet kulstofmaterialer til at rense spildevandKredit:CC0 Public Domain Affaldsstrømme fra industri og landbrug kunne bruges til produktion af kul, der kan tjene som en billig adsorbent til vandrensning. I sit speciale på Industridoktoralskole -
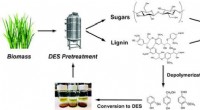 Vedvarende opløsningsmidler afledt af lignin sænker spild i biobrændstofproduktionBioraffinaderi-konceptet, der bruger fornybare dybe eutektiske opløsningsmidler (DES) afledt af ligninråvarer, er vist her. Kredit:US Department of Energy Et bioraffinaderi med lukket kredsløb kan
Vedvarende opløsningsmidler afledt af lignin sænker spild i biobrændstofproduktionBioraffinaderi-konceptet, der bruger fornybare dybe eutektiske opløsningsmidler (DES) afledt af ligninråvarer, er vist her. Kredit:US Department of Energy Et bioraffinaderi med lukket kredsløb kan -
 Forskere introducerer idé til nye molekyler, innovation, værdiLedere fra National Science Foundation Engineering Research Center for Biorenewable Chemicals (CBiRC) baseret på Iowa State University foreslår en ny model til at skabe, ansøger, og kommercialisering
Forskere introducerer idé til nye molekyler, innovation, værdiLedere fra National Science Foundation Engineering Research Center for Biorenewable Chemicals (CBiRC) baseret på Iowa State University foreslår en ny model til at skabe, ansøger, og kommercialisering -
 Video:Hvad gør elektrolytter egentlig?Kredit:The American Chemical Society Sportsdrik-reklamer elsker at tale om dem, men hvad er elektrolytter, hvorfor har vi brug for dem, og hvad sker der, hvis vi ikke har nok? Elektrolytter er sa
Video:Hvad gør elektrolytter egentlig?Kredit:The American Chemical Society Sportsdrik-reklamer elsker at tale om dem, men hvad er elektrolytter, hvorfor har vi brug for dem, og hvad sker der, hvis vi ikke har nok? Elektrolytter er sa
- Hvilket komplekst kulhydrat er en opbevaringsform for energi i planter?
- Hvorfor er de indre planeter tæt og små, mens ydre gasgiganter?
- Hvordan din hyggelige fleece kunne forurene havet
- Forskere forbedrer elektronspinets levetid
- Hvor vigtig er Henri Fayol for videnskabelig ledelse?
- Svøbe seksuel vold i Vestafrika, afsløret


