Når ikke -metaller reagerer med andre atomer fra ikke -metaller?
* ikke -metaller Har en høj elektronegativitet, hvilket betyder, at de har en stærk tendens til at tiltrække elektroner.
* kovalente obligationer form, når to atomer deler elektroner for at opnå en mere stabil elektronkonfiguration, der normalt ligner en ædel gas.
Her er hvorfor dette sker:
* ikke -metaller er generelt på udkig efter at få elektroner til at fylde deres ydre skal og opnå en stabil konfiguration.
* Deling af elektroner Tillader dem at opnå denne stabilitet uden fuldstændigt at overføre elektroner som i ioniske bindinger.
Eksempler på, at ikke -metaller reagerer for at danne kovalente obligationer:
* ilt og brint Formvand (H₂O)
* kulstof og ilt Form kuldioxid (CO₂)
* nitrogen og brint form ammoniak (NH₃)
* klor og fluor Form klor monofluorid (CLF)
Nøglepunkter:
* Kovalente obligationer kan være enkelt, dobbelt eller tredobbelt Afhængig af hvor mange elektroner deles.
* De resulterende molekyler er typisk gasser eller væsker ved stuetemperatur , med lave smelte- og kogepunkter.
* Kovalente forbindelser har en tendens til at være dårlige ledere af elektricitet På grund af manglen på frit bevægende elektroner.
Kortfattet: Ikke -metaller reagerer med andre ikke -metaller ved at dele elektroner for at danne kovalente bindinger, hvilket fører til oprettelse af molekyler med unikke egenskaber.
Sidste artikelHvad sker der, når EDTA tilsættes til en opløsning af ammoniak og kobbersulfat?
Næste artikelHvad er isotopen af brint?
 Varme artikler
Varme artikler
-
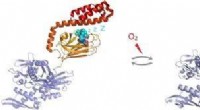 S-glutathionylering af human-inducerbar Hsp70 afslører reguleringsmekanisme, der involverer C-termi…Figur:Under oxidative stressforhold, den molekylære chaperon Hsp70 undergår post-translationel modifikation af cysteinrester ved tilsætning af tripeptidet glutathion. Glutathionylering inden for det s
S-glutathionylering af human-inducerbar Hsp70 afslører reguleringsmekanisme, der involverer C-termi…Figur:Under oxidative stressforhold, den molekylære chaperon Hsp70 undergår post-translationel modifikation af cysteinrester ved tilsætning af tripeptidet glutathion. Glutathionylering inden for det s -
 Bakteriebaseret beton giver klimafordeleBeton genererer enorme mængder drivhusgasser. Derfor ser forskere på at producere mere miljøvenlige former for dette vigtige byggemateriale. Kredit:Shutterstock Byggebranchen udleder enorme mængde
Bakteriebaseret beton giver klimafordeleBeton genererer enorme mængder drivhusgasser. Derfor ser forskere på at producere mere miljøvenlige former for dette vigtige byggemateriale. Kredit:Shutterstock Byggebranchen udleder enorme mængde -
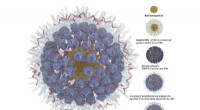 Kunne guld være nøglen til at lave genterapi for HIV, blodsygdomme mere tilgængelige?Grafik af en fuldt ladet guld nanopartikel med CRISPR og andre genredigeringsværktøjer. Kredit:Adair-laboratoriet hos Fred Hutch. Forskere ved Fred Hutchinson Cancer Research Center tog et skridt
Kunne guld være nøglen til at lave genterapi for HIV, blodsygdomme mere tilgængelige?Grafik af en fuldt ladet guld nanopartikel med CRISPR og andre genredigeringsværktøjer. Kredit:Adair-laboratoriet hos Fred Hutch. Forskere ved Fred Hutchinson Cancer Research Center tog et skridt -
 Ny metode omdanner metan i naturgas til methanol ved stuetemperaturAfbrænding af metan i naturgas bidrager til kulstofemissioner, men metan omdannet til flydende methanol er et renere brændstof. Kredit:Aditya Prajapati og Meenesh Singh/UIC Forskere ved University
Ny metode omdanner metan i naturgas til methanol ved stuetemperaturAfbrænding af metan i naturgas bidrager til kulstofemissioner, men metan omdannet til flydende methanol er et renere brændstof. Kredit:Aditya Prajapati og Meenesh Singh/UIC Forskere ved University


