Hvis 6,0 g jern reagerede med klor, hvad er det maksimale antal mol-jern-II-chlorid, der kan produceres?
1. Skriv den afbalancerede kemiske ligning:
Fe (S) + Cl₂ (G) → Fecl₂ (S)
2. Beregn molen af jern:
* Molær jernmasse (Fe) =55,845 g/mol
* Mol Fe =(6,0 g) / (55,845 g / mol) =0,107 mol
3. Bestem molforholdet:
* Fra den afbalancerede ligning reagerer 1 mol Fe for at producere 1 mol fecl₂.
4. Beregn den maksimale mol af jern-II-chlorid (fecl₂):
* Da molforholdet er 1:1, er den maksimale mol af fecl₂ produceret lig med molen af Fe:0,107 mol fecl₂
Svar: Det maksimale antal mol jern-II-chlorid (fecl₂), der kan produceres, er 0,107 mol .
 Varme artikler
Varme artikler
-
 Undersøgelse af atomstruktur af aluminiumslegeringer til fremstilling af moderne flyKredit:Pixabay/CC0 Public Domain Forskere fra Belgorod State University (BSU) og Skolkovo Institute of Science and Technology (Skoltech) studerede aluminiumslegeringer på atomniveau og fandt mønstr
Undersøgelse af atomstruktur af aluminiumslegeringer til fremstilling af moderne flyKredit:Pixabay/CC0 Public Domain Forskere fra Belgorod State University (BSU) og Skolkovo Institute of Science and Technology (Skoltech) studerede aluminiumslegeringer på atomniveau og fandt mønstr -
 Omdannelse af kuldioxid til butanol ved hjælp af phosphorrige kobberkatoderForskere fra Gwangju Institute of Science and Technology udviklede en metode til direkte at generere 1-butanol, en alternativ brændstofkilde, fra CO 2 ved brug af kobberphosphidelektroder. Kredit:Gw
Omdannelse af kuldioxid til butanol ved hjælp af phosphorrige kobberkatoderForskere fra Gwangju Institute of Science and Technology udviklede en metode til direkte at generere 1-butanol, en alternativ brændstofkilde, fra CO 2 ved brug af kobberphosphidelektroder. Kredit:Gw -
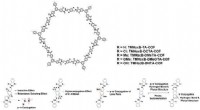 Redigering af lysemitterende organiske molekyler via overflademodifikationFigur 1. Ændringer i lysemission via forstyrrelse af vægoverfladesteder i kovalente organiske rammer (COFer). Ved at introducere forskellige atomer eller små grupper i porestederne af hydrazon-forbund
Redigering af lysemitterende organiske molekyler via overflademodifikationFigur 1. Ændringer i lysemission via forstyrrelse af vægoverfladesteder i kovalente organiske rammer (COFer). Ved at introducere forskellige atomer eller små grupper i porestederne af hydrazon-forbund -
 Går med DNA-strømmen:Livets molekyle finder nye anvendelser i mikroelektronikForskere ved Arizona State University, i samarbejde med NYU og Duke University, har for nylig designet, skabt og testet et DNA-kredsløb, der er i stand til at opdele og kombinere strøm, meget som en a
Går med DNA-strømmen:Livets molekyle finder nye anvendelser i mikroelektronikForskere ved Arizona State University, i samarbejde med NYU og Duke University, har for nylig designet, skabt og testet et DNA-kredsløb, der er i stand til at opdele og kombinere strøm, meget som en a


