Hvorfor zink fortrænger natrium i hydroxid, der er inspireret af at være mindre reaktiv end det?
* Zink fortrænger ikke direkte natrium fra natriumhydroxid (NaOH). Natrium er et meget reaktivt metal, og det vil let reagere med vand for at danne natriumhydroxid og brintgas:
2 NA (S) + 2 H₂O (L) → 2 NaOH (AQ) + H₂ (G)
* Hvad der faktisk sker er en reaktion mellem zink og natriumhydroxidopløsning. Zink reagerer med hydroxidionerne (OH-) i opløsningen, ikke med natriumionerne (Na+). Denne reaktion danner zinkationer (Zn (OH) ₄²⁻) og frigiver brintgas:
Zn (S) + 2 NaOH (AQ) + 2 H₂O (L) → Na₂zn (OH) ₄ (AQ) + H₂ (G)
Det centrale punkt: Denne reaktion handler ikke om, at zink er mere reaktiv end natrium. Det handler om de specifikke kemiske forhold og dannelsen af en mere stabil forbindelse. Zinkationer er mere stabile end frie zinkioner i en grundlæggende opløsning og driver reaktionen fremad.
Her er hvorfor zink danner zinkationer:
* amfoterisk karakter af zink: Zinkoxid (ZnO) og zinkhydroxid (Zn (OH) ₂) er amfoterisk, hvilket betyder, at de kan reagere med både syrer og baser. I en grundlæggende opløsning danner zink komplekse ioner som zinkat (Zn (OH) ₄²⁻).
* stabilitet af den komplekse ion: Zinkationen er et stabilt kompleks på grund af koordineringen af hydroxidioner omkring zinkionen.
Kortfattet: Reaktionen mellem zink- og natriumhydroxid er en kompleks proces, der involverer dannelse af et stabilt zinkationsion og frigivelse af brintgas. Det handler ikke blot om, at zink er mere reaktiv end natrium.
 Varme artikler
Varme artikler
-
 Afsløret manglende trin i lipiddannelsen kunne muliggøre påvisning af tidligere klimaerEt team fra Penn State og University of Illinois Urbana-Champaign har fastslået det manglende trin i dannelsen af et molekyle kaldet GDGT, som er en lovende kandidat til brug som en indikator for ti
Afsløret manglende trin i lipiddannelsen kunne muliggøre påvisning af tidligere klimaerEt team fra Penn State og University of Illinois Urbana-Champaign har fastslået det manglende trin i dannelsen af et molekyle kaldet GDGT, som er en lovende kandidat til brug som en indikator for ti -
 Vandbehandling - ny metode eliminerer hormonerMetoden udviklet af KIT kombinerer fordelene ved at binde mikroforurenende stoffer med aktivt kul med fordelene ved ultrafiltrering. Kredit:Sandra Göttisheim, SÆT Hormoner og andre mikroforurenend
Vandbehandling - ny metode eliminerer hormonerMetoden udviklet af KIT kombinerer fordelene ved at binde mikroforurenende stoffer med aktivt kul med fordelene ved ultrafiltrering. Kredit:Sandra Göttisheim, SÆT Hormoner og andre mikroforurenend -
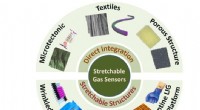 Forskere udvikler sensorer, der registrerer menneskelige biomarkører og giftig gasEt forskningshold fra Penn State, ledet af Huanyu Larry Cheng, Dorothy Quiggle Karriereudviklingsprofessor i Penn State Department of Engineering Science and Mechanics, udforsker forskellige nanomater
Forskere udvikler sensorer, der registrerer menneskelige biomarkører og giftig gasEt forskningshold fra Penn State, ledet af Huanyu Larry Cheng, Dorothy Quiggle Karriereudviklingsprofessor i Penn State Department of Engineering Science and Mechanics, udforsker forskellige nanomater -
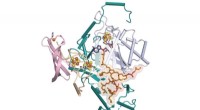
 At se nærmere på genetiske skift i kræftEn krystalstruktur af en del af menneskelig DPF2, et protein, der styrer en genetisk switch, der fortæller blodstamceller, hvornår de skal blive røde og hvide blodlegemer. Orange og gule områder illus
At se nærmere på genetiske skift i kræftEn krystalstruktur af en del af menneskelig DPF2, et protein, der styrer en genetisk switch, der fortæller blodstamceller, hvornår de skal blive røde og hvide blodlegemer. Orange og gule områder illus
- Nanoneedle-gennembrud giver håb om billigere kræftbehandling
- Analyse af milliarder af Twitter-ord afslører, hvordan amerikansk engelsk udvikler sig
- Hvad Darwin ikke kunne se:Ekspedition for at afsløre usynligt liv på Galápagos
- L-kondrit-opløsning kan have bidraget til ordovicisk biodiversificering
- Hvad er hvid støj?
- Billig, tilgængelig enhed giver visuelt bevis på, at masker blokerer dråber


