Overgangsmetaller såsom kobber- eller wolfram danner forbindelser af?
1. Ionisk binding:
* Overgangsmetaller kan miste elektroner til dannelse af positivt ladede kationer. Disse kationer danner derefter ioniske bindinger med negativt ladede anioner.
* Eksempel: Cu²⁺ (kobber (II) ion) danner ioniske bindinger med Cl⁻ (chloridioner) for at skabe kobber (II) chlorid (Cucl₂).
2. Kovalent binding:
* Overgangsmetaller kan også dele elektroner med andre atomer til dannelse af kovalente bindinger.
* Eksempel: Wolfram danner kovalente bindinger med ilt i wolframoxid (wo₃).
3. Koordinatbinding:
* Overgangsmetaller kan acceptere elektronpar fra ligander (molekyler eller ioner, der donerer elektroner). Dette danner koordinatobligationer, som er en type kovalent binding.
* Eksempel: Kobber (II) ioner danner koordinatbindinger med vandmolekyler til dannelse af det hydratiserede kobber (II) ion [Cu (H₂O) ₄] ²⁺.
4. Metallisk binding:
* Overgangsmetaller kan danne metalliske bindinger med andre metalatomer. Dette involverer delokalisering af elektroner på tværs af et gitter af metalatomer.
* Eksempel: Ren wolfram udviser metallisk binding.
5. Kompleks dannelse:
* Overgangsmetaller kan danne koordinationskomplekser, som involverer metalionen omgivet af en gruppe af ligander. Disse komplekser udviser ofte unikke egenskaber og farver.
* Eksempel: Den komplekse ion [Fe (CN) ₆] ⁴⁻ (ferrocyanid) er et koordinationskompleks med en central jernion omgivet af seks cyanidligander.
Faktorer, der påvirker binding:
* Oxidationstilstand: Oxidationstilstanden for overgangsmetal kan påvirke den type binding, den danner.
* ligandtype: Arten af liganderne (f.eks. Deres elektronegativitet, størrelse) kan også påvirke bindingen.
* Elektronisk konfiguration: Den elektroniske konfiguration af overgangsmetallet spiller en rolle i bestemmelsen af dens reaktivitet og evne til at danne forskellige typer bindinger.
Afslutningsvis danner overgangsmetaller forbindelser gennem en kombination af ioniske, kovalente, koordinat og metalliske bindingsmekanismer, hvilket ofte fører til dannelse af komplekse og farverige forbindelser.
 Varme artikler
Varme artikler
-
 Principper for en grøn kemifremtidKredit:CC0 Public Domain I det seneste nummer af det akademiske tidsskrift Videnskab , sagen er lavet for en fremtid, hvor de materialer og kemikalier, der udgør grundlaget for vores samfund og
Principper for en grøn kemifremtidKredit:CC0 Public Domain I det seneste nummer af det akademiske tidsskrift Videnskab , sagen er lavet for en fremtid, hvor de materialer og kemikalier, der udgør grundlaget for vores samfund og -
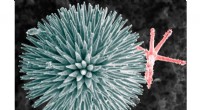 Nærmere kig afslører aksiale filamenter i havsvampspikler, der består af proteinerElektronmikroskopibillede af glasspikler fra svampen Geodia cydonium. Kredit:Zlotnikov Group, B TERNING, TU Dresden Et team af forskere med medlemmer fra Frankrig, Tyskland og Israel har fundet ud
Nærmere kig afslører aksiale filamenter i havsvampspikler, der består af proteinerElektronmikroskopibillede af glasspikler fra svampen Geodia cydonium. Kredit:Zlotnikov Group, B TERNING, TU Dresden Et team af forskere med medlemmer fra Frankrig, Tyskland og Israel har fundet ud -
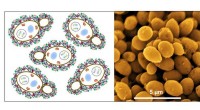 Design af vandspaltningskatalysatorer ved brug af affaldsgærbiomasseMulti-heteroatom-dopet kulstof fra affaldsgærbiomasse til vedvarende vandspaltning. Kredit:Professor Kwang S. Kim, UNIST En ny katalysatorsyntesemetode, i stand til at generere brint fra gær, de v
Design af vandspaltningskatalysatorer ved brug af affaldsgærbiomasseMulti-heteroatom-dopet kulstof fra affaldsgærbiomasse til vedvarende vandspaltning. Kredit:Professor Kwang S. Kim, UNIST En ny katalysatorsyntesemetode, i stand til at generere brint fra gær, de v -
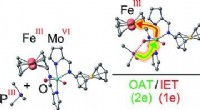 Bioinspireret enzymmodel med redox -switchKredit:Wiley Koblede oxygenoverførsler og elektronoverførselsreaktioner, der anvender kofaktorer, er enzymatiske reaktioner af afgørende betydning for alle livsformer fra bakterier til hvirveldyr.
Bioinspireret enzymmodel med redox -switchKredit:Wiley Koblede oxygenoverførsler og elektronoverførselsreaktioner, der anvender kofaktorer, er enzymatiske reaktioner af afgørende betydning for alle livsformer fra bakterier til hvirveldyr.
- Hvilket afsnit om periodisk tabel er guld?
- Hvor meget vejer en semi-lastbil?
- Sådan finder du spænding og strøm over en kreds i serie & i Parallel
- Store solidnonterede sfæriske massesthe, der er mest berømt, hvoraf EarthWhich drejer sig om din s…
- Nylon som byggesten til gennemsigtige elektroniske enheder?


