Beregn antallet af mol ilt, der vil opløses i 45 L vand ved 20C, hvis delvist tryk er 0,21 ATM Henrys konstant for 0,0013 mol ATM?
Forstå Henrys lov
Henrys lov siger, at opløseligheden af en gas i en væske er direkte proportional med det delvise tryk på gassen over væsken. Matematisk:
* c =kp
Hvor:
* C er koncentrationen af den opløste gas (i mol/l)
* k er Henrys lov konstant (i mol/(l · atm))
* p er det delvise tryk på gassen (i ATM)
Beregninger
1. Anvend Henrys lov:
* Vi har det delvise ilttryk (P =0,21 atm) og Henrys konstante (K =0,0013 mol/(L · atm)).
* Udskift disse værdier i Henrys lovligning for at finde koncentrationen (c):
* C =(0,0013 mol/(L · atm)) * (0,21 atm) =0,000273 mol/l
2. Beregn mol ilt:
* Vi kender koncentrationen af ilt i vandet (C =0,000273 mol/L) og vandmængden (45 L).
* For at finde den samlede mol af opløst ilt skal du multiplicere koncentrationen med volumen:
* Mol ilt =(0,000273 mol/L) * (45 L) = 0,012285 mol
Derfor opløses ca. 0,012285 mol ilt i 45 liter vand ved 20 ° C med et delvist tryk på 0,21 atm.
Sidste artikelHvad er den kemiske formel for propangrill?
Næste artikelElementer eller forbindelser, der indgår i en kemisk reaktion?
 Varme artikler
Varme artikler
-
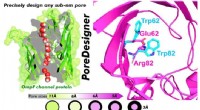 PoreDesigner forbedrer proteinkanaldesign til vandbehandling, bioseparationerFigur, der skitserer det grundlæggende i PoreDesigners arbejdsgang til ændring af porestørrelsen af et bakteriekanalprotein. Kredit:Manish Kumar / Penn State PoreDesigner, en fuldt automatiseret
PoreDesigner forbedrer proteinkanaldesign til vandbehandling, bioseparationerFigur, der skitserer det grundlæggende i PoreDesigners arbejdsgang til ændring af porestørrelsen af et bakteriekanalprotein. Kredit:Manish Kumar / Penn State PoreDesigner, en fuldt automatiseret -
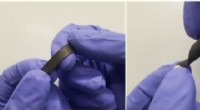 Den følsomme belastningssensor, der kan registrere vægten af en fjerStrækker og vrider de ultrafølsomme belastningssensorer. Kredit:University of Sussex Fysikere har skabt den mest følsomme belastningssensor, der nogensinde er lavet, i stand til at registrere en f
Den følsomme belastningssensor, der kan registrere vægten af en fjerStrækker og vrider de ultrafølsomme belastningssensorer. Kredit:University of Sussex Fysikere har skabt den mest følsomme belastningssensor, der nogensinde er lavet, i stand til at registrere en f -
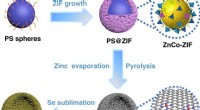 Team afslører en enkel metode til at producere højtydende lithium-selenbatterierSAC forberedelsesproces. Kredit: Naturkommunikation (2020). DOI:10.1038/s41467-020-18820-y Genopladelige lithium-ion-batterier (LIBer) betragtes som det bedste håb for næste generations batterite
Team afslører en enkel metode til at producere højtydende lithium-selenbatterierSAC forberedelsesproces. Kredit: Naturkommunikation (2020). DOI:10.1038/s41467-020-18820-y Genopladelige lithium-ion-batterier (LIBer) betragtes som det bedste håb for næste generations batterite -
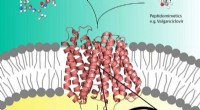 Røntgenbilleder afslører layout af lastet lægemiddeltransportørPro-lægemidler som Valganciclovir (øverst til højre) kan bruge peptidtransportøren (i midten) i cellemembranen, der normalt transporterer næringsstofpeptider (øverst til venstre) ind i cellen. Kredit:
Røntgenbilleder afslører layout af lastet lægemiddeltransportørPro-lægemidler som Valganciclovir (øverst til højre) kan bruge peptidtransportøren (i midten) i cellemembranen, der normalt transporterer næringsstofpeptider (øverst til venstre) ind i cellen. Kredit:


